高三化学同步测试(1)
物质组成、化学式
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分150分,考试用时120分钟。
可能用到的相对原子质量(原子量):H-1 C-12 O-16 N-14 Ca-40
Cl-35.5 P-31
第Ⅰ卷(选择题,共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有1个选项符合题意)
某矿泉水标签上印有下列字样:主要成分(单位:mg/L)Ca:20.2,K:39.l,Mg:3.27,Zn:0.06,F:0.02,重碳酸:7,偏硅酸:4,不含CO2 回答下列1一2题:
1.标签上的“Ca、K、Mg、Zn、F ”是指 ( )
A. 单质 B.元素 C.原子 D.分子
2.标签上“不含 CO2”说明 ( )
A.这种矿泉水是纯净的
B.不能溶解在这种矿泉水中
C.这种矿泉水没有分解出CO2
D.这种矿泉水灌瓶前除去了CO2
3.无机化学中也存在同分异构体,互为同分异构体的一组无机物是 ( )
A.NH4CNO与尿素CO(NH2)2
B.H2O与D2O
C.[Cr(H2O )5Cl]Cl2·H2O 与[Cr(H2O )4Cl2]Cl·2H2O
D. Si(OH)4 与H4SiO4
4.将下列各组物质按酸、碱、盐分类顺序排列。正确的是 ( )
A.硫酸、纯碱、石膏
B.氢溴酸、烧碱、绿矾
C.石炭酸、乙醇、醋酸钠
D.磷酸、熟石灰、苛性钾
 |
5.下列电子式书写正确的是 ( )
6.“混盐”是指一种金属离子与多种酸根离子构成的盐,如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐。“复盐”是指含有多种简单阳离子和一种酸根阴离子的盐如KAl(SO4)2,下列各化合物中属于混盐的是 ( )
A. CaOCl2 B.(NH4)2Fe(SO4)2
C. BiONO3 D.K3[Fe(CN)6]]
7.航天技术测得三氧化二碳(C2O3)是金星大气层的成份之一,下列关于C2O3的说法中错误的是 ( )
A.C2O3与CO2都是碳的氧化物
B.C2O3与CO2都是碳酸的酸酐
C.C2O3与CO都具有还原性
D.C2O3与C的燃烧产物都是CO2
8.下列物质都能使品红溶液褪色,其中褪色的原因与化学反应无关的是 ( )
A. 过氧化钠 B.漂白粉与盐酸的混合物
C. 活性炭 D.二氧化硫
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有1或2个选项符合题意。若正确答案只包括一个选项, 多选时, 该题为0分; 若正确答案只包括两个选项, 只选一个且正确的给2分, 选两个都正确的给4分, 但只要选错一个, 该小题就为0分)
9.下列叙述不正确的是 ( )
A.只有一种元素的阳离子和一种元素的阴离子构成的物质不一定是纯净物
B.最外层电子数相同的微粒化学性质相似
C.凡是能发生放热或吸热、生成气体或沉淀等现象的变化,一定属于化学变化
D.物质在变化时,原子只是重新组合,未变成别的原子,这种变化是物理变化
10.在体积为 v L的密闭容器中通入 a molNO2和 b mol SO2,发生下列反应,NO2+ SO2
=NO+ SO3,反应后容器内硫原子数和氧原子数之比为 ( )
A.3b /a B.b/2(a+ b)
C.b/2a D.b/(a+ 3b)
11.某氯原子的质量是a g 12C原子的质量是bg,用NA表示阿伏加德罗常数,下列说法中正确的是。 ( )
A.氯元素的相对原子质量为 12a/b
B.m g该氯原子的物质的量一定是m/a NA
C.该氯原子的摩尔质量是aNAg
D.n g该氯原子所含的电子数为17n/a
12.有五瓶溶液分别是:①10mL 0.60mol/LNaOH水溶液,②20mL 0.50mol/LH2SO4水溶液,③30ml 0.40mol/LHCl水溶液,④40mL 0.30mol/L醋酸水溶液,⑤50mL0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是 ( )
A.①>②>③>④>⑤ B.②>①>③>④>⑤
C.②>③>④>①>⑤ D.⑤>④>③>②>①
13.在反应 X+ 2Y= R+2M中,已知 R和 M的摩尔质量之比为 22: 9,当l. 6g X与 Y完全反应后,生成4.4gR,则此反应中Y和M的质量之比为 ( )
A.16:9 B.23:9 C.32:9 D.46:9
14.某些化学试剂可用于净水。水处理中使用的一种无机高分子混凝剂的化学式可表示为
[A12(OH)nClm·yH2O]x,式中m等于 ( )
A.3—n B.6-n C.6+n D. 3+n
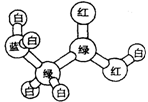 15.某期刊封面上有如下一个分子的球棍模型图, 图中“棍”代表单键或双键或三键。不同颜色的球代表不同元素的原子,该模型图可代表一种 ( )
15.某期刊封面上有如下一个分子的球棍模型图, 图中“棍”代表单键或双键或三键。不同颜色的球代表不同元素的原子,该模型图可代表一种 ( )
A.卤代羧酸 B.酯
C.氨基酸 D.醇钠
16.下列离子方程式正确的是( )
A. 氢氟酸与氢氧化钾溶液反应:
H++OH-=H2 O
B. 硫化钠溶于水显碱性:
S2-+ 2H2O=H2S↑+ 2OH-
C. 硝酸铁溶液中加过量氨水:
Fe3++ 3NH3·H2O=Fe(OH)3 ↓+ 3NH4+
D. 硫酸铜溶液中加入氢氧化钡溶液:
Ba2++ SO42-=BaSO4 ↓
17.美国发射的航天器已将我国研制的质谱仪带入太空,其目的是探索反物质的存在。反物质的主要特征是电子带正电荷、质子带负电荷。以下可表示反物质酸和碱中和反应实质的是
( )
A.H-+ OH+=H2O B.H++ OH-= H2O
C. H++ OH+= H2O D.H-+OH-= H2O
18.被誉为“太空金属”的钛,在室温下,不与水、稀硫酸、稀盐酸和稀硝酸作用,但易溶于氢氟酸,其原因可能是 ( )
A.氢氟酸的酸性比其他酸强
B.氢氟酸的氧化性比其他酸强
C.氢氟酸的还原性比其他酸强
D.钛离子易与氟离子形成可溶性难电离物质
第II卷 (非选择题满分78分)
三、本题包括2小题, 共18分
19. (本小题共9分) (1)已知在一定条件下可发生反应:2KClO3+ I2=2KIO3+ C12,此反应属于________反应(从分解、化合、置换、复分解反应中选择填空)。有人据此认为碘的非金属性比氯强,你认为对吗?(错对与否,都需说明原因)_______________________________________ ___
_____________________________________________________________________________
(2)某文献指出:“ AlCl3、SnCl4等为共价化合物,而不是离子化合物”。请你设计一个实验证实其结论的正确性。
答:________________________________________________________________________
__________________________________________________________________________
20. (本小题共11分)(1)氰化钾、氰化氢的制备反应的化学方程式为:
a. K2CO3+ C+ 2NH3=2KCN+ 3H2O; △H = 276kJ/mol
b.CO+ NH3=HCN+H2O ; △H = 46kJ/mol
①氰离子为负一价阴离子,其中碳、氮元素的化合价分别为________;电子式是______。
②a、b两反应中_是氧化还原反应,请指出其中的氧化剂和还原剂分别是_____________。
③a反应中,如果有4 mol NH3参加,则______(填放出、吸收)_______kJ的热量。
(2)制备纯净无水氰化氢(沸点299K)的一种方法是:混合磨细的KCN和KHS粉末,适度加热,写出反应的化学方程式______________________________________。
四、本题包括2小题, 共18分
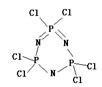
21. (本小题共6分) 在有机溶剂里使 n mol PC15与 n mol NH4Cl定量地发生完全反应,释放出 4n molHCl,同时得到一种白色晶体A。实验测得A的相对分子质量为348。
①生成A晶体的化学方程式:_________________________________________。
②分子结构测定实验表明:A分子中具有六元环结构,同种元素在A分子中所处的环境等
同且满足P五价、N三价、Cl一价。试推测A分子可能的结构(写结构式):______。
22.(本小题共12分) (1)一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式 XY2(l)+3O2(g)=XO2(g)+ 2YO2(g)。冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g/L,则①反应前O2的体积(标况)是___________;②化合物XY2的式量是____;③若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为_________和___________。
(2)在一定体积的容器中,以1:5的体积比充入氙和氟,于400℃和2633kPa压强下反应。数小时后,迅速冷却至25℃,得到一种无色晶体。此时容器内的气体减少到原来的一半,且剩余气体全是氟。由此可知,无色晶体的化学式是__________,在该晶体中,氙的化合价是 。
五、本题包括2小题, 共20分
23.(本小题共8分)在120℃时分别进行如下四个反应:
A.2H2S+O2==2H2O +2S B.2H2S+ 3O2= 2 H2O +2SO2
C. C2H4 + 3 O2== 2H2O+2CO2 D.C4H8 + 6 O2== 4H2O+4CO2
(1) 若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(P)分别符合关系式d前==d后和P前>P后的是___________。符合关系式d前==d后和P前==P后的是_________(填反应代号)。
(2) 若反应在压强恒定容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后的是____________;符合d前>d后和V前>V后的是____________。(填反应代号)。
24.(本小题共12分) 已知反应 2A+ 3B= 6C+ D中, A是由X、Y两种元素组成,B是由Z元素组成的单质,C、D分子都是由两个原子构成。根据以上条件,填写有关空格。
| 物质代号 | A | B | C | D |
| 该物质中元素的种类 | 2 | 1 | ||
| 每个分子中原子的总数目 | 2 | 2 | ||
| 其中可能的一种分子组成 |
六、本题包括2小题, 共20分
25.(本小题共8分) 三聚磷酸钠(Na3P3O10)是洗衣粉的组成成分之一,含该物质的废水排入河流会造成水质富营养化,导致藻类大量繁殖。由于藻类遗体的氧化而消耗水中溶解的氧气,从而使水质变黑、变臭,造成河水污染,水的pH明显下降,水生动物因缺氧而大量死亡。
(1)若某藻类物质的化学式(分子式)为C106H263OxNyP,测知其式量(相对分子质量)为3550,且其中氧元素与氮元素的质量为55:7,则 x =__________,y=___________。
(2)该藻类物质被O2完全氧化的化学方程式为:_____________________________。
26. (本小题共12分)过氧化钙是一种安全无毒的氧化物,通常含有部分CaO且带有数量不等的结晶水。为分析某过氧化钙样品的组成,进行了如下实验。
①称取0.270g样品,灼热使之完全分解,生成 CaO、O2和 H2O,得到的O2在标准状况下体积为33.6mL。②另取0.120g样品,溶于稀盐酸,加热煮沸,使生成的H2O2完全分解。然后将溶液中的Ca2+完全转化成CaCO3沉淀,经过滤洗涤后,,将沉淀溶于热的稀硫酸,用0.0200mol/LKMnO4溶液滴定,共用去31.0mL KMnO4溶液。化学方程式如下:
5CaC2O4+ 2KMnO4+ 8H2SO4==K2SO4+ 2MnSO4+ 5CaSO4+ 10CO2↑十8H2O
(1)写出CaO2受热分解的化学方程式。
(2)计算样品中 CaO2的质量分数。
(3)计算样品中 CaO2·xH2 O的x值。
化学参考答案与评分标准(一)
一、二选择题(1~18小题每题4分,共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | D | C | B | B | A | B | C | BD |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | B | D | A | B | C | C | A | D |
19.(1)置换,(2分)错误,本反应说明I2的还原性比Cl2强, 即I的还原性比Cl强。(4分)
(2) AlCl3、SnCl4固体分别在熔融状态下, 进行导电实验, 不能导电, 说明熔融状态下无自由移动的阴阳离子, AlCl3、SnCl4未电离, AlCl3、SnCl4为分子晶体, 是共价化合物。
(5分) 本题共7分
20.(1) ①+2,-3 [ C N ]-(3分)②a K2CO3, C (3分)③吸收 552(2分)
|
(2) KCN+KHS==HCN↑+K2S(3分) 本题共11分
|
②
(3分) 本题共6分
22. ⑴①672mL②76③C,S ⑵XeF4,+4(12分)
23. ⑴B,C⑵D,A(8分)
24.
| A | B | C | D |
| 2 | 1 | ||
| X3Y | Z2 | XZ | Y2 |
分析反应式2A+ 3B= 6C+ D, 推至生成物共有14个原子
设A为XmYn,B为Zp
则有 2m+2n+3p=14, 可知p为偶数,p=2 m+n=4;p=4 m+n=1不成立;p>4 m+n<0不成立。
![]()
![]() m=1 m=3
m=1 m=3
n=3 n=1
![]() 即A为X3Y或XY3,B为Z2,C为XZ或YZ,D为Y2或X2 (12分)
即A为X3Y或XY3,B为Z2,C为XZ或YZ,D为Y2或X2 (12分)
![]() 25. 解: 16x :14y=55:17
解得 x=110
25. 解: 16x :14y=55:17
解得 x=110
12×106+263+16x+14y+31=3550 y=16 (4分)
氧化后水的pH明显下降, 说明N→HNO3 P→H3PO4
C106H263O110N16P+143O2→106CO2+ 16HNO3+ H3PO4+122H2O (4分) 本题共8分
答: 略
|
26. 解: (1) 2CaO2 == 2CaO+O2↑(3分)
(2)n(O2)=33.6×10-3L/22.4L·mol-1=1.50×10-3mol
3.30×10-3mol
CaO2的质量分数ω(CaO2)= 3.00×10-3mol×72g·mol-1/0.270g×100%=80.0%(3分)
(3) 根据关系式
5Ca2+ ~ 2MnO4-
(1.55×10-3mol) 31×0.02××10-3mol
0.120g样品中n(CaO2)=0.120g×3.00×10-3mol/0.270g=1.33×10-3mol
n(CaO)=1.55×10-3mol-1.33×10-3mol=2.2×10-4mol
n(CaO2·xH2O)= 1.33×10-3mol(3分)
2.2×10-4mol×56g/mol+1.33×10-3mol×(72+18x)g/mol==0.120g(3分)
x=0.5
答: 略 本题共12分
 V
V