高三化学同步测试(3)—物质结构元素周期律
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分150分,考试用时120分钟。
可能用到的相对原子质量(原子量):
H-1 C-12 O-16 N-14 Ca-40 K-39 Cu-64 Fe-56 S-32 Cl-35.5 Na-23 F-19
第Ⅰ卷(选择题,共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有1个选项符合题意)
1.据最新报道,1996年2月 9日欧洲一科学家小组,由3066Zn和82208Pb两原子经核聚合,并放出一定数目的中子而制得第112号元素质量数为227的同位素。则两原子在核聚合过程中放出的中子数目是 ( )
A.47 B.115 C.142 D.162
2.最新科技报导,美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新微粒是由3个氢原子核(只含质子)和2个电子构成,对于这种微粒,下列说法中正确的是( )
A.是氢的一种新的同素异形体
B.是氢的一种新的同位素
C.它的组成可用H3表示
D.它比一个普通H2分子多一个氢原子核
3. 与羟基具有相同质子数和电子数的微粒是 ( )
A.OH- B.N
C.-NH2 D.CH3+
4.下列各组物质中,都是由分子构成的一组化合物是 ( )
A.CO2、NO、SiO2 B.CH4、H2SO4、C6H5OH
C.HD、H2O2、H2O D.NH3、HCl、NH4Cl
5.在下列比较中,正确的是 ( )
A.受热稳定性:HI>HBr>HCl>HF
B.分子中的键角:CH4=H2O<CO2
C.微粒半径: F-< Na+< Mg2+
D.单质的熔点: Li> Na> K> Rb
6.下列说法正确的是 ( )
A.分子中都存在共价键
B. ![]() U→
U→![]() Pb十
Pb十![]() Ne+ 8
Ne+ 8![]() n属于化学变化
n属于化学变化
C.质子数相等,电子数也相等的两种微粒可能是不同的离子
D.CaF2和 Na2O2的化学键和晶体类型均相同
7.CaC2和 MgC2都是离子化合物,下列叙述中正确的是 ( )
A.MgC2和 CaC2都能跟水反应生成乙炔
B.C22-的电子式为[C:: C]2-
C.CaC2在水中以 Ca2+和 C22一形式存在
D. MgC2的熔点低,可能在 100℃以下
8.硼有两种天然同位素510B和511B,硼元素的原子量为 10.80,则硼元素中510B质量分数约为 ( )
A.20% B.80% C.18.5% D.21.5%
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有1或2个选项符合题意。若正确答案只包括一个选项, 多选时, 该题为0分; 若正确答案只包括两个选项, 只选一个且正确的给2分, 选两个都正确的给4分, 但只要选错一个, 该小题就为0分)
9.下列分子中所有原子都满足最外层8电子结构的是 ( )
A.光气(COCl2) B.六氟化硫
C.二氟化氙 D.三氯化磷
10.X、Y是短周期元素,两者能形成化学式为X2Y3的化合物.已知X的原子序数为n,则Y的原子序数可能为①n+3,②n-3,③n-1 ④n-5,⑤n+1.其中正确的是 ( )
A.①④ B.②③
C.①④⑤ D.全部
11.能说明BF3分子的4个原子在同一平面中的理由是 ( )
A.B-F键为非极性键 B. 任意两个B—F键之间的键角为120”
 C.三个B-F键的键能相同 D. 三个B-F键的键长相等
C.三个B-F键的键能相同 D. 三个B-F键的键长相等
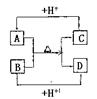
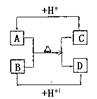
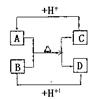
12.常见的离子晶体类型有5种,如图是其中一种空间构型,则该晶体中X、
Y的离子个数之比可能为 ( )
A.4: l B.2:1 C.1: 1 D.1:2
13.下列物质的结构有正四面体单元且键角为109°28′的是①CH4 ②NH4+③CH3Cl ④P4 ⑤SO42- ⑥金刚石 ( )
A.①②③⑥ B.①②④⑥ C.①②⑤⑥ D.①④⑤
14.两个原硅酸分子的羟基间可以相互作用脱去一分子水生成H6Si2O7,已知原硅酸的结
OH
![]()
构为HO-Si一OH,则在所得H6Si2O7的分子结构中含有的硅氧键数目为 ( )
![]()
OH
A. 5 B. 6 C. 7 D.8
15.判断物质在不同溶剂中的溶解性时,有一条经验规则;“极性分子组成的溶剂易于溶解极性分子组成的溶质;非极性分子组成的溶剂易于溶解非极性分子组成的溶质。”下列装置中,不适宜用作HCl气体尾气吸收的是 ( )
|
|
|
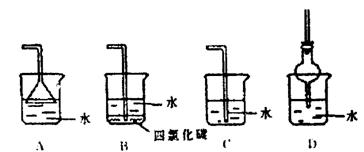
16.建材中的放射性物质衰变会生成具有放射性的氡气,我们吸入氡气后会有害于健康,氡元素的原子序数是86,相对原子质量是222,科学家还发现某些放射性矿物分解放出的“锕射气”是由质子数86,质量数219的一种原子组成。下列有关氡的说法正确的是( )
A.氡气在标准状况下的密度约是9.91g/L
B.氡气化学性质较活泼,因此对人体有害
C.氡原子核外有七个电子层,最外层有8个电子
D.“锕射气”是氡的同素异形体
17.英国科学家发现的C60是一种新的分子,它具有空心的类似足球的结构,被称为”分子足球”。最近日本科学家确认世界上还存在着另一种“分子足球N60”,它与C60的结构相似所且在高温或机械撞击后,其中积蓄的巨大能量会在一瞬间释放出来。对于 N60,下列说法正确的是 ( )
A.N60是由共价键构成的交心圆球面结构,所以它是一种原子晶体
B.N60没有同素异形体
C.N60与14N都是氮的同位素
D.N60将来可能成为非常好的火箭材料
18.某离子R2+的最外层有2个电子,且有5个电子层,当固体RCl2溶于水配成溶液时,需加入少量单质R和盐酸。由此推断下列叙述正确的是 ( )
A.R为IIA族元素
B.R的最高价氧化物的水化物是强碱
C.R2+的硝酸盐的水溶液呈酸性
D.RCl2具有还原性,容易进一步被氧化
第II卷 (非选择题满分78分)
三、本题包括2小题, 共21分
19. (本小题共8分)用原子结构理论解释钠、镁、铝的还原性强弱。并用实验确认之,除钠块、镁片、铝片外还可选用的试剂有①HCl②HNO3③蒸馏水④酚酞试液。
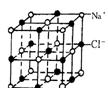 20.(本小题共13分) 右图为氯化钠晶体结构。
20.(本小题共13分) 右图为氯化钠晶体结构。
(1)晶体中,每个Na+周围有____个Cl-,每个Cl-周围与它最接近且距离相
等的Cl一共有_____个。
(2)在NaCl晶体中,与Na+距离等同且最近的几个Cl一所围成的空间几何
构型为_____(填序号)
A. 正四面体 B. 正六面体 C.正八面体 D.正十二面体
(3) 若Na+ 、Cl-的最近距离是a cm, 则氯化钠晶体的密度是_____________
(4)
若用实验方法测定氯化钠晶体的密度, 根据ρ=![]() ,利用_________________(填仪器名称)测得氯化钠晶体质量m ;将该晶体小心放入一量筒中,
用______式滴定管滴加_______(选填下列试剂), 量筒读数V1 , 滴定管前读数V2, 滴定管后读数V3, 则V=__________(填V1 、V2、V3代数式)。
,利用_________________(填仪器名称)测得氯化钠晶体质量m ;将该晶体小心放入一量筒中,
用______式滴定管滴加_______(选填下列试剂), 量筒读数V1 , 滴定管前读数V2, 滴定管后读数V3, 则V=__________(填V1 、V2、V3代数式)。
A.水 B.四氯化碳 C.汽油 D.硝酸银溶液
四、本题包括2小题, 共19分
![]() 21.(本小题共8分) 某书本查得相对原子质量数据摘录如下:
21.(本小题共8分) 某书本查得相对原子质量数据摘录如下:
| 35Cl | 34.969 | 75.77% | 35Cl | 35 | 75.77% |
| 37Cl | 36.966 | 24.23% | 37Cl | 37 | 24.23% |
| 35.453 | 35.485 |
(1)34.969表示_________________________ (2)35表示_________________________
(3) 35.453表示_____________________(4) 得35.485的计算式是______________________
22. (本小题共11分) 致冷剂是一种易被压缩、液化的气体(致冷剂分子一般是①式量_____,或②分子之间存在______键),液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的。人们曾采用过乙醚、NH3,CH3Cl等作致冷剂,但它们不是有毒,就是易燃。于是科学家根据元素性质的递变规律来开发新的致冷剂。据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:
第二周期 _______>_______>H2O>HF; 第三周期SiH4>PH3>________>________。
(2)化合物的毒性:
PH3>NH3 H2S______H2O;CS2_______CO2 CCl4>CF4(以上选填>或<=)
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新致冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的致冷剂氟里昂CCl2F2终于诞生了,其它类似的还可以是________(举一例)
(4)然而,这种致冷剂造成了当今的某一环境问题是__________________。但求助于周期表中元素及其化合物的_____________变化趋势来开发致冷剂的科学思维方法是值得借鉴的。(后一空格选填字母) ①毒性②沸点③易燃性④水溶性⑤颜色
A.①②③ B. ②④⑤ C.②③④
五、本题包括2小题, 共19分
|
(1)A、D的电子式分别为:A____________,D_______________。
(2)B、C、D三种微粒结合质子能力x>y>z,(x、y、z分别代表B、
C、D中的某一种微粒),则x、y、z分别代表的微粒符号为x________,
y__________,z________
(3)请分别用离子方程式说明结合质子能力x>y>z的判断依据:
x>y:___________________________________________
y>z:___________________________________________
24.(本小题共10分) A、B、C、D、E、F六种短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 化合物中各元素的原子个数比 | A:C=1:1 | B:A=1:2 | D:C=1:1 | E:F=1:3 | B:F=1:4 |
已知A、B两元素的核电荷数之差等于其原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;C原子的最外层电子数是次外层电子数的3倍;D、E、F同周期,D与A同主族;E与F的原子序数之和为30;丙是离子化合物。
(l)F元素位于周期表中第___周期___族;E离子结构示意图是____;丙的电子式是_____。
(2)向甲的水溶液中加入MnO2,反应的化学方程式为__________________________。
(3)丁的水溶液与NaHCO3溶液混合会生成气体和沉淀,反应的离子方程式为
_______________________________________________________。
六、本题包括2小题, 共19分
25.(本小题共9分) 第ⅣA族元素R, 在它的化合物R(OH)n中,其质量分数是0.778, 在它的另一种化合物R(OH)m中,其质量分数是0.636。
(1)试求n和m的值: n=______________, m=____________。
(2)试求R的相对原子质量M( R)=____________ 。
26. (本小题共10分) 电解含重水(D2O) 的水, 得到H2 、HD 、D2的混和气体, 现有1L含重水0.017%(质量分数) 的水, 设其密度仍为1 g/cm3, 将其完全电解后,分离得到HD、D2的混和气体,其平均相对分子质量是3.5,试计算 HD、D2混和气体的各体积(标准状况下)?
参考答案与评分标准(三)
一、二选择题(1~18小题每题4分,共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | A | D | C | B | D | C | A | C | AD |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | B | D | C | D | C | A | D | CD |
19.(1) 钠、镁、铝随着核电苘数的增加, 原子半经逐渐减小, 原子核对最外层电子的束缚力逐渐增强, 失去最外层电子的能力逐渐减弱, 原子的还原性逐渐减弱。(4分)
(2) 将钠块、镁片、铝片分别放入盛水(另加2~3滴酚酞)的试管中, 钠剧烈反应, 溶液呈红色, 说明钠的还原性大于镁、铝,另2支试管加热至沸, 镁片试管中溶液呈红色, 铝片几乎无现象, 说明镁的还原性强于铝。(或另2支试管中注入盐酸, 镁片试管中气体逸出速率明显快于铝片试管, 说明镁的还原性强于铝) (4分) 本题共8分
20.⑴6,12(4分) ⑵C (2分)⑶58.5/2a3NA (2分) ⑷托盘天平, (1分)酸 , (1分) B, (1分) V1+V2-V3(2分) 本题共13分
21. ⑴ 35Cl的相对原子质量 ⑵35Cl的质量数 ⑶氯元素的平均相对原子质量 ⑷氯元素的近似相对原子质量 (8分)
22. ①较大②氢键 ⑴CH4 NH3 , H2S HCl ⑵ > > ⑶CClF3 ⑷ 臭氧层空洞,A
(本题共11分)
23.
⑴[H:N:H]+ H:O:H (2分) ⑵OH- NH3 H2O(3分)
⑶x>y: OH- +NH4+ ==NH3↑+H2O (2分)
y>z: NH3+H3O+ == NH4+ +H2O (2分) 本题共9分
MnO2
24. ⑴三, ⅦA; +13 2 8 ;Na+[:O:O:]2-Na+ (4分)⑵ 2H2O2==2H2O+ O2↑ (3分)
⑶Al3++3HCO3-==Al(OH)3↓+3CO2↑ (3分) 本题共10分
25. 解:R是第ⅣA族元素, 其主要化合价为+2、+4。R(OH)n中,其质量分数是0.778,化合物R(OH)m中,其质量分数是0.636, 0.778>0.636, 猜测n=2, m=4。设元素R的相对原子质量是M, 则
M:17×2 =0.778:0.222 M==119.1
M:17×4 =0.636:0.364 M= 118.8 猜测成立。
⑴ n=2, m=4 (6分)⑵M(R)=119(3分)
答: 略 本题共9分
26. 解:m(D2O)=1000mL×1g·mL-1×0.017%=0.017g
n(D2O)=0.0085mol(3分)
D原子完全进入HD、D2中, 设生成HD的物质的量为x, 生成D2的物质的量为y
![]() x+2y==0.0085mol×2
x+2y==0.0085mol×2
x×3g/mol +y×4g/mol==(x+y)×3.5g/mol
解得:x=y=0.017mol/3(4分)
HD、D2的体积:V(HD)=V(D2)=22.4L/mol×0.017mol/3=0.127L(3分)
答: 略 本题共10分