高三化学同步测试(4)—化学反应速率、化学平衡
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分150分,考试用时120分钟。
可能用到的相对原子质量(原子量):
H-1 C-12 O-16 N-14 Ca-40 I-127 S-32 Cl-35.5 Na-23
第Ⅰ卷(选择题,共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有1个选项符合题意)
1.当可逆反应2SO2+O2= SO3达平衡时, 通入18O2, 再次平衡时, 18O存在于 ( )
A.SO3 O2 B.SO2 SO3
C. SO2 O2 D. SO2 O2 SO3
2.甲基橙为一种常用指示剂,酸性溶液中显红色,中性或碱性溶液中显黄色,在溶液中(甲基橙用HIn表示)存在如下电离平衡HIn=H++In-,下列说法中不正确的是 ( )
A.加酸平衡向逆反应方向移动
B.加碱HIn的电离程度增大
C.HIn分子显红色,In一显黄色
D.HIn分子显黄色,In一显红色
3.改变以下反应的条件,能提高反应物活化分子百分率的是①温度②浓度③压强④正催化剂
A.①④ B.②③
C.①② D.③④
4.在一密封烧瓶中注入 NO2,在 25℃时建立下列平衡: 2NO2(g)=N2O4(g); △H<0,若把烧瓶置于100℃的沸水中,下列哪些情况不变, ①颜色②平均分子量③质量④压强⑤△H ⑥密度
( )
A.③⑤⑥ B.③④⑤
C.②④ D.①③
5.把下列四种x的溶液,分别加入盛有10mL2mol/L盐酸的烧杯中,并均加水稀释到50mL,此时x和盐酸缓和地进行反应,其中反应速率最大的是 ( )
A.20mL2mol/L B.10mL5mol/L
C.20mL3mol/L D.10mL3mol/L
6.反应 2A(g)=2B(g)十E(g); △H>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是 ( )
A.加压 B.减压 C.减少c(E) D.降温
7.在一定条件下,可逆反应 A(g)+ B(g)=2C(g)达到平衡的标志是 ( )
①A、B、C的分子数比为1:1:2
②A、B、C的浓度不再产生变化
③ 单位时间生成n摩尔 A,同时增加2n摩尔 C
④平衡体系中的压强不再发生变化
A.①② B.①④ C.②③ D.②④
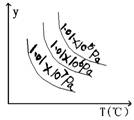
 8.如图,曲线 a表示一定条件下,可逆反应 X(g)+ Y(g)=2Z(g)
8.如图,曲线 a表示一定条件下,可逆反应 X(g)+ Y(g)=2Z(g)
+ W(s); △H<0的反应过程。若欲使a曲线变为b曲线,可采取
的措施是 ( )
A.加入催化剂 B.增大Y的浓度
C.降低温度 D.减小反应体系压强
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有1或2个选项符合题意。若正确答案只包括一个选项, 多选时, 该题为0分; 若正确答案只包括两个选项, 只选一个且正确的给2分, 选两个都正确的给4分, 但只要选错一个, 该小题就为0分)
9.下列事实不能用勒沙特列原理解释的是 ( )
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.钢铁在潮湿的空气中容易生锈
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
10.将 lmolSO2和 l mol O2 通入体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡时 SO3为0.3mol,若此时移走 0.5mol O2和 0.5mol SO2则反应达到新的平衡时,SO3的物质的量是 ( )
A.0.3mol B.0.15mol
C.小于 0.15mol D.大于0.15mol而小于 0.3mol
11.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐
酸中加入适量的 ( )
A.NaOH固体
B.少量硫酸铜溶液
C.H2O
D.CH3 COONa 固体
12.在密闭容器中,一定量混合气体发生下列反应: aM(g)+ bN(g)=cW(g),达一平衡后,测得M气体的浓度为0.5mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是 ( )
A.反应速率增大
B.平衡向右移动
C.N的转化率提高
D.W的体积分数降低
|
A.8 B.6 C.5 D.3
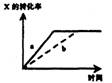
14.右图所示外界条件(温度、压力)变化对下列反应的影响 X(s)
+ M(g)=2N(g); △H>0,图中 y轴指的是 ( )
A.平衡混合气中的N的百分含量
B.平衡混合气中M的百分含量
C.M的转化率
 D.X的转化率
D.X的转化率
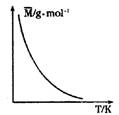
15.可逆反应 2X+ Y =2Z(g); △H<0,气体的平均摩尔质量(M)
随温度变化如图所示,则下列说法正确的是( )
A.X和Y可能都是固体
B.X和Y一定都是气体
C.若Y为固体,X一定是气体
D.X和Y可能都是气体
16.有一个固定体积的密闭容器中,保持一定温度,进行以下反应:
H2(g)+ Br2(g)=2HBr(g),已知加入 l mol H2和 2mol Br2时,达到平衡后,生成 a molHBr。在相同条件下, 起始时加人H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡后各组分的物质的量分数不变,以下推断不正确的是: ( )
A.x、y、z应满足的关系是 y= 2x
B.x、y、z应满足的关系是 4x+z= 2y
C.达平衡时 HBr的物质的量为(x+y+z)a/3
D.达平衡时HBr物质的量一定仍为a mol
17.在一2L密闭容器中,盛有2molX和 2molY物质进行如下反应: X(s)+3Y(g)=Z(g),当反应进行10s后,测得生成0.5mo lZ,则这期间的平均反应速率为 ( )
A.vZ=0.025mol/(L·s) B.vX.=0.025mol/(L·s)
C.vY=0.05mol/(L·s) D.vY=0.075mol/(L·s)
18.在容积为20L的真空密闭容器中,充入0.lmol H2和 0.2mol碘蒸气,加热到t1℃后,发生反应: H2(g)+ I2(g)= 2HI(g); △H<0,测得H2的转化率为50%。再升温到t2℃ 时,HI的浓度又变成t1℃时的一半,整个过程中体积不变,则在t2℃时混合气体的密度为( )
A.2.12g/L B.2.55g/L
C.3.06g/L D.3.18g/L
第II卷 (非选择题 满分78分)
三、本题包括2小题, 共24分
19. (本小题共14分) 已知氯水中有如下平衡:Cl2+H2O == HCl+HClO。常温下,在一个体积为50 mL的针筒里吸入40 mL氯气后,再吸进10mL水。
(1)写出针筒中可能观察到的现象_________________________________________________。
(2) 若将此时针筒长时间放置,又可能看到何种变化_________________________________,试用平衡观点加以解释__________________________________________ __________。
(3) 若把针筒中氯水分成Ⅰ、Ⅱ、Ⅲ份。第Ⅰ份加少量固体NaHSO3, 第Ⅱ份加少量固体NaHCO3, 则三份氯水中c(HClO) 的大小是____>______>________。
(4) 若在针筒中的氯水中加入氢氧化钠的酚酞试液, 红色褪去。其原因可能的解释有两种,分别是①____________________________②______________________。如何用实验方法确认上述原因:___________________________________________________________________。
20. (本小题共10分) 甲、乙、丙三个化肥厂生产尿素所用的原料不同,但生产流程相同:
![]()
![]() →CO→CO2
→CO→CO2
原料— →CO(NH2)2
→ H2 →NH3
试解答下列问题:
(1)用化学方程式表示甲、乙、丙三个工厂合成尿素的原料气H2和CO2的生产过程
①甲厂以焦炭和水为原料;
________________________________、______________________________________________
②乙厂以天然气和水为原料;
________________________________、______________________________________________
③丙厂以石脑油(主要成分为C5 H12)和水为原料:
_________________________________、_____________________________________________
(2)按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的物质的量)和CO2的物质的量之比,则对原料的利用率最高。据此判断甲、乙、丙三个工厂哪个工厂对原料的利用率最高?____________。
(3)写出合成尿素的化学方程式的热方程式(可逆的放热反应,CO(NH2)2的反应热是127kJ/mol,CO(NH2)2为固体、水是气体),请设计工业合成尿素的条件
____________________________________________________________________________。
四、本题包括2小题, 共17分
21.(本小题共6分) (1)某温度下,浓度都是l mol/L的两种单质气体X2和Y2,在密闭容器中反应生成气体Z。达到平衡时,X2、Y2、Z的浓度分别为0.4mol/L、0.7mol/L、0.4mol/L则该反应的化学方程式是____________________________。
(2)298K时,合成氨反应的热化学方程式为 N2(g)+ 3H2(g)=2NH3(g); △H=-92.4kJ/mol,
在该温度下,取 l mol N2和 3mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总是小于 92.4kJ,其原因是___________________________________。
22. (本小题共11分) 5370C、1.01×105Pa时,往容积可变的密闭容器中充入2molSO2、1molO2,此时容器的体积为200L。向容器中加入催化剂(固体)并保持恒温恒压,发生反应:
2SO2(g)+O2(g)== 2SO3(g)
达到平衡时,平衡气体中 SO3的体积分数为 0.91。
试回答下列问题:
(l)工业上二氧化硫的催化氧化采用常压而不采用高压的原因是:
___________________________________________________________________________
(2)保持上述温度和压强不变,若向容器中只充入2molSO3并加入固体催化剂。则平衡时,SO2的体积分数是_____________,容器的体积为___________L。
(3)温度仍保持5370C,容器体积保持200L不变(恒容)。充入 a molSO2、b molO2,并加入固体催化剂,反应达到平衡时,SO3的体积分数仍为0.91,体系压强为 1.01×105Pa。若a: b=2:1, 则a=___________。
五、本题包括2小题, 共18分
23. (本小题共11分) 某反应A(g)+B(g)= 2C(g)在任一时刻的正、逆反应速率可用v正和v逆表示,v正=k1c(A)c(B),v逆=k2c(C)2,其中 k1、k2在一定温度下均为常数,c(A) 、c(B) 、c(C)分别代表某时刻三种物质的物质的量浓度。
(l)在一容积为 2升的密闭容器中,放入 A、B各0.20mol,在 300K时反应,达平衡时 B的转化率为50%,则k1、k2之间的关系为_______________。
(2)此反应达平衡后,若维持容器的体积和温度不变,向容器中注入A、B、C的混和气体(物质的量之比A:B:C=1:1:2),平衡将如何移动?___________。(填“向正反应方向移动”、“向逆反应方向移动”或“不移动”)
(3)在300K时,若 k1= 1.0 ×10-5 s· L/mol,且c(A) =c(B) =c(C)=0.010mol/L时,反应是否处于平衡状态_____________。(填“是”或“否”),平衡时,各物质的浓度分别为c(A) =__________,c(B) =_____________,c(C)=____________ 。
24. (本小题共7分) 某化学反应2A==B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验序号 温度/℃ 0 10 20 30 40 50 60
1 800 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 800 c1 0.60 0.50 0.50 0.50 0.50 0.50
3 800 c2 0.92 0.75 0.63 0.60 0.60 0.60
4 820 1.0 0.40 0.25 0.20 0.20 0.20 0.20
根据上述数据,完成下列填空;
(1)在实验1,反应在l0min至20 min时间内平均速率为_____________mol/(L·min)
(2)在实验2,A的初始浓度c2= _________mol/L,反应经达平衡,可推测实2中还隐含的条件是_________________________________.
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1,则υ3_υ1;(填>、=、<=,且C3 _________1.0mol/L (填>、=、<).
(4)比较实验4和实验1,可推测该反应是_________________反应(选填吸热、放热).
六、本题包括2小题, 共19分
25.(本小题共10分) 将N2和 H2按一定比例混合,在相同状况下其密度是H2的 3.6倍,取0.5mol该混合气体通入密闭容器内,使之发生反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.76倍,试求:
(1)反应前混合气体中N2和 H2的体积比;
(2)达到平衡时混合气体中的氨的物质的量;
(3)平衡时N2的转化率。
26. (本小题共9分) 在恒温时,向某密闭容器中通入2 mol X和l mol y气体,发生如下反应:2X(g)+Y(g) ==2Z(g),压强一定时,测得在平衡时 Z的体积分数为 0.4。
(1)与上述平衡保持同温、同压,若向密闭容器中通入4 mol X(g)和 2 mol Y(g).达到平衡,则Z的体积分数为_________;平衡时,气体的总物质的量是____________________。
(2)与上述平衡保持同温、同压,若向密闭容器中通入X(g)和Y(g)的物质的量分别记为n(X)、n(Y),并满足平衡时Z的体积分数为0.4,则![]() 的取值范围为__________。
的取值范围为__________。
化学参考答案及评分标准(四)
一、二选择题(1~18小题每题4分,共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | D | D | A | A | C | D | C | D | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | CD | D | D | B | CD | AD | AD | B |
19.⑴针筒向里缩进, 气体体积减小, 气体、溶液颜色变浅。(2分)
⑵气体、溶液颜色接近无色, 最终仍有气体, 大约是原氯气的一半。
|
2HClO == HCl+O2↑ , HClO的减少, 原平衡不断向右移动, Cl2减少, 生成O2。理论上讲: 2Cl2+2H2O→4 HCl+O2。(4分)
⑶Ⅱ>Ⅲ>Ⅰ(2分)
⑷①氯水中的次氯酸对酚酞漂白②NaOH和氯水反应, 溶液不再呈碱性酚酞褪色。向已褪色的溶液中滴加NaOH溶液,如溶液呈红色,则是②原因,否则是①原因。(6分)
本题共14分
|
|
⑴ ①C+H2O==CO+H2 CO+H2O=====CO2+H2
|
|
②CH4+H2O=====CO+3H2 CO+H2O====CO2+H2
|
|
③C5H12+5H2O ==== 5CO+11H2 CO+H2O ===== CO2+H2 (3分)
⑵丙。CO2+2NH3== CO(NH)2+ H2O, N2 +3H2===2NH3, 合并得计算关系式:
CO2+3H2→CO(NH)2 ,(1)中①CO2~2H2 ② CO2~4H2 ③ 5CO2~16H2,可确定丙最接近1:3。(4分)
⑶高压、催化剂、适宜的温度。(3分) 本题共10分
21. ⑴ 3X2(g)+ Y2(g)== 2X3Y(g) (3分)
⑵该反应是可逆反应, 原料气不可能完全反应, 即l mol N2和 3mol H2生成NH3小于2mol, 因此放出的热量小于92.4kJ (3分) 本题共6分
22.(1) 常压下, 三氧化硫的含量已达91%,从成本考虑, 没有必要再加压(4分),(2)6%,137.5L(4分) (3)2.91 (3分) 本题共11分
23. ⑴k1=4k2 (2分)⑵不移动(2分) ⑶否, 0.0075 mol/L 0.0075 mol/L 0.0150 mol/L(7分)本题共11分
24. ⑴0.013 (2分)⑵ 1.0 , 加入催化剂(2分)⑶ >;> (2分)⑷吸热 (1分) 本题共7分
25. 解: ⑴0.5mol混合气体中:
![]() 28g/mol ×n(N2)+2g/mol×n(H2)=0.5mol×3.6g/mol
28g/mol ×n(N2)+2g/mol×n(H2)=0.5mol×3.6g/mol
n(N2)+ n(H2) =0.5mol
n(N2)=0.1mol n(H2)=0.4mol V(N2):V(H2)= n(N2): n(H2) =1:4(4分)
|
N2 + 3H2 2NH3
起始/mol 0.1 0.4 0
变化/mol a 3a 2a
平衡/mol 0.1-a 0.4-3a 2a
0.1-a+0.4-3a + 2a==0.76×0.5 a==0.06
平衡时 n(NH3)==0.12 mol(4分)
⑶平衡时的N2转化率=amol/0.1mol=60%(3分)
答: 略 本题共10分
26. 解: ⑴两平衡处于等温、等压下n(X):n(Y) 相同, 则两平衡等效
|
2X(g) + Y(g) 2Z(g)
起始/mol 2 1 0
变化/mol 2a a 2a
平衡/mol 2-2a 1-a 2a
![]() =0.4 a=0.5 Z的体积分数是0.4 气体的总物质的量为5.0 mol (4分)
=0.4 a=0.5 Z的体积分数是0.4 气体的总物质的量为5.0 mol (4分)
|
2X(g) + Y(g) 2Z(g)
起始/mol n(X) n(Y) 0
变化/mol 2b b 2b
平衡/mol n(X)-2b n(Y)-b 2b
![]() 2b/[ n(X)-2b+ n(Y)-b +2b ]=0.4
2b/[ n(X)-2b+ n(Y)-b +2b ]=0.4
n(X)-2b >0
n(Y)-b >0
当 n(Y) =b时, n(X) / n(Y) =5
当 n(X)=2b n(X) / n(Y) =0.5
0.5<n(X) / n(Y) <5 (5分)
答: 略 本题共9分