高三化学同步测试(6)—电化
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分150分,考试用时120分钟。
可能用到的相对原子质量(原子量):H-1 C-12 O-16 N-14 Ca-40 K-39 Cu-64
Fe-56 S-32 Cl-35.5 Na-23 Ag-108 Al-27 Ba-137 Zn-65
第Ⅰ卷(选择题,共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有1个选项符合题意)
1.钢铁暴露在潮湿的空气中会发生析氢腐蚀或吸氧腐蚀,发生吸氧腐蚀时正极反应式为( )
A.4H++ 4e-= 2H2↑ B.2H2O+O2+ 4e一 =4OH-
C.2Fe一 4e- =2Fe2+ D.4OH一—4e一=2H2O+O2↑
2.下列过程需要通电才可进行的是:①电离②电解③电镀④电泳⑤电化腐蚀。 ( )
A.①②③ B.②③④ C.②④⑤ D.全部
3.关于原电池和电解池的叙述正确的是 ( )
A.原电池失去电子的电极称为阴极
B.电解池的阳极、原电池的负极都发生氧化反应
C.原电池的两极,一定要由活动性不同的两种金属组成
D.电解时电解池的阳极一定是阴离子放电
4.下列关于铜电极的叙述正确的是 ( )
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时,粗铜作阴极
C.在镀件上电镀铜时,可用金属铜作阴极
D.电解稀硫酸制H2、O2时,铜作阳极
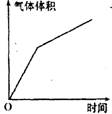 5.用石墨电极持续电解下列溶液(电流强度不变),阳极上产生气体
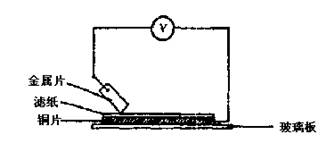
5.用石墨电极持续电解下列溶液(电流强度不变),阳极上产生气体
的量可能发生右下图所示变化的是( )
A.KI溶液 B.Na2 SO4溶液
C.CuSO4溶液 D.NaCl溶液
6.用 Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的 200mL0.3mol/ L NaCl溶液和300 mL0.2mol/ L的AgNO3溶液,当产生0.56L(标准状况)Cl2时停止电解,取出电极,将两杯溶液混合,混合液的pH为(设混合后溶液的总体积为500mL) ( )
A.1.4 B.5.6 C.7 D.12.6
7. 生物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成微型的生物原电池,下列有关判断正确的是 ( )
A.负极发生的电极反应可能是: O2+4e-+2H2O=4OH-
B.正极发生的电极反应可能是: O2+4e-=2O2-
C.负极反应主要是C6H12O6生成CO2或 HCO3-
D.正极反应主要是 C6H12O6生成 CO2或 CO32-
8.按装置图进行实验,若右图的X轴表示流入阴极的电
子的量,则y轴不可能表示的是(假设溶液的体积不变)( )
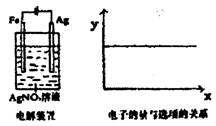 A.Ag+物质的量浓度
A.Ag+物质的量浓度
B.NO3-物质的量浓度
C.溶液的pH
D. 银棒的质量
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有1或2个选项符合题意。若正确答案只包括一个选项, 多选时, 该题为0分; 若正确答案只包括两个选项, 只选一个且正确的给2分, 选两个都正确的给4分, 但只要选错一个, 该小题就为0分)
9.下列说法正确的是 ( )
A.原电池中电子从正极经外电路流向负极
B.原电池中电流从正极经外电路流向负极
C.电解池中电子从阳极经外电解液流向阴极
D.电解池中电流从阳极经外电解液流向阴极
10.有两只串联的电解池,甲池盛有CuSO4溶液,乙池盛有一定量某硝酸盐的稀溶液,电解时当甲池中电极质量增加1.6gCu时,乙池析出0.45g固体,则乙池的溶质可能是( )
A.AgNO3 B.NaNO3
C.Mg(NO3)2 D.Al(NO3)3
11.用石墨作电极电解 100mLH2SO4和 CuSO4的混合溶液,通电一段时间后,两极均收集到2.24L气体(标准状况下),原混合溶液中Cu2+的物质的量浓度为 ( )
A.1mol/L B.2mol/L
C.3 mol/L D.4 mol/L
12.在水中加入等物质的量的AgNO3、Ba(NO3)2、NaCl、K2SO4混合均匀,取溶液,用惰性电极电解,片刻后在两个极区析出的氧化产物与还原产物的物质的质量之比为( )
A.35.5:108 B.l:2
C.108:35.5 D.8:1
13.用导线连接的镁条和铝片投入氢氧化钠溶液中, 形成后电池
A.镁作正极, 发生还原反应
B.镁作负极, 发生氧化反应
C.铝作负极, 发生氧化反应
D.铝作正极, 发生还原反应
14.常温下镀锌铁片表面破损发生析氢腐蚀时,若有0.2mol电子发生转移,下列说法一定正确的是 ( )
A.有5.6g金属被腐蚀
B.有4.48L气体放出
C.有6.5g金属被腐蚀
D.有2.24L气体放出
15.工业上①电解熔融Al2O3②电解熔融MgCl2③电解饱和NaCl溶液, 分别通过相同电子数时, 生成气体的物质的量大小是 ( )
A.①②③ B.③②①
C.③①② D.②③①
16.用石墨电极电解饱和CuSO4溶液,一段时间后断开电路,要使溶液恢复到电解前浓度应向其中加入适量的 ( )
A.CuSO4 B.H2O
C.CuO D.Cu(OH)2
17.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为: ( )
|
|
A.Ag B.Zn(OH)2
C.Ag2O D.Zn
18.下列关于实验现象的描述中不正确的是
A.把铜片和铝片紧靠在一起浸入稀硫酸中, 铜片表面出现气泡
B.用锌片作阳极, 铁片作阴极, 电解氯化锌溶液, 铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中, 在铜片表面一层铁
D.实验室制H2, 把锌粒加入稀硫酸中, 再加几滴硫酸铜溶液, 气泡放出速率加快
第II卷 (非选择题 满分78分)
三、本题包括2小题, 共20分
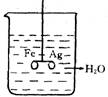 19.(本小题共8分) 如右图,(1)在银圈和铁圈(用细塑料棒连接)的连接处吊
19.(本小题共8分) 如右图,(1)在银圈和铁圈(用细塑料棒连接)的连接处吊
着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶
液。①片刻后可观察到的现象是________________________。②产生上 述现象的原因是_________________________________。
(2) 将(1) 中细塑料棒取下, 使两环靠拢, 连接处吊着一个绝缘的细丝,调整圈的大小, 使 之平衡, 然后小心地从烧杯中央滴入CuSO4溶液。①片刻后可观察到的现象是_____________________ ___。②产生上述现象的原因是___________________________ ______。
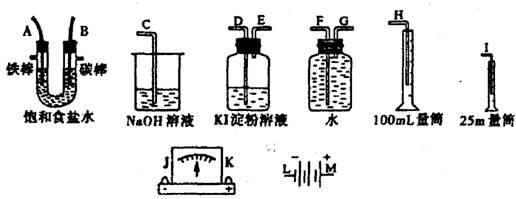
20.(本小题共12分) 请从下图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。
(1)A极发生的电极反应式是________,B极发生的电极反应式是____________。
(2)电源、电流表,与A、B两极的正确连接顺序为L→( )→( )→( )→( )→M。
(3)设计上述气体实验装置时,各接口的正确连接依序为
_______ 接________、_________接A、B接_________、_________接__________。
(4)已知饱和食盐水50mL,电流强度为IA,通电为 t min时,测得H2体积为 16.8mL(标况),此时溶液 pH约为___________,阿伏加德罗常数表达式NA为_______________(电子电量为l.6×10-19C, lg3=0.5)
四、本题包括2小题, 共18分
21. (本小题共8分) 已知在 0.lmol/L/的 NaHSO3溶液中有关微粒浓度由大到小的顺序为:
c(Na +)>c(HSO3-)>c(SO32-)>c(H2SO3)
①则该溶液中c(H+)______c(OH-)(填“>” “=”“<” =简述理由(并用离子方程式表示)__________________________________
②现向NH4HSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可观察到的现象是______________________ ___;写出该反应的离子方程式______________________ _______。
③用铂电极电解NaHSO3溶液, 则总化学方程式是___________________________。
22. (本小题共10分) 将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如右图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下;
|
| 金属 | 电子流动方向 | 电压(V) |
| A | A→Cu | + 0. 78 |
| B | Cu→B | -0.15 |
| C | C→Cu | + 1.35 |
| D | D→Cu | +0.30 |
已知:构成两电极的金属其金属活泼性相差越大,电压表的读数越大。
请依据表中数据判断:
(1)____________金属可能是最强的还原剂;____________金属一定不能从硫酸铜溶液中置换出铜。
(2)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到的蓝色沉淀析出的是_____________(填字母)金属。其对应的原电池的电极反应式为:
负极____________________,正极_____________________。
五、本题包括2小题, 共20分
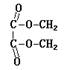
23.(本小题共10分) 电解羧酸类金属盐的溶液,可得到脱去羧基后的有机物。例如,
|
2CH3COOK+2H2O == C2H6↑+2CO2↑+H2↑+2KOH。现将CH3COOK改为ClCH2COOK溶液,根据衍变关系, 回答有关问题。
|
|
|
|
|
|
![]() ClCH2COOK溶液 → A(混和物) → B溶液 → 纯净物B → C → D
E
ClCH2COOK溶液 → A(混和物) → B溶液 → 纯净物B → C → D
E
(1)ClCH2COOK水溶液的电极反应式(惰性电极)为:
阴极:__________________________, 阳极________________________________。
(2) A(混和物) 的主要成分___________________
(3)B的结构简式为________________________________
(4) 设B和C的氧化均很完全。D与B以物质的量之比为1:1反应生成E,在不同的反
应条件下, E的结构有能有多种。若E为一种含有六原子环状结构的有机物,则E的结构简式是_________________________。
24.(本小题共10分) 化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
|
|
已知Ni(OH)2 和Cd(OH)2均难溶于水仅能溶于酸,以下说法中正确的是______
①以上反应是可逆反应②以上反应不是可逆反应③充电时化学能转变为电能④放电时化学能转变为电能
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为
__________________________________________________________________________。
(3)另一种常用的电池是锂电池(锂是一种碱金属元素, 其相对原子质量为7), 由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起博器,一般使用时间可长达十年,它的负极用金属锂制成,电池总反应可表示为:Li+MnO2→LiMnO2
试回答:锂电池比容量特别大的原因是__________________________________________。(4)锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?
请用化学方程式表示其原因:________________________________________________。
六、本题包括2小题, 共21分
25.(本小题共7分) 在 25℃时,将两个铜电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,在阴极逸出a mol气体,同时有mgNa2SO4·10H2O晶体析出,若温度不变,此时,剩余溶液的溶质的质量分数为多少?
26.(本小题共14分) 在 500g CuSO4溶液中插入两极电极,一极为铁,另一极为含杂质锌均匀的粗铜。通电一段时间后,切断电源,立即将电极取出,此时铁电极上析出7.04g铜,而电解质溶液变为500 .02g。若铜电极上铜锌的组成比例与通电前相同,求铜电极上含杂质锌的质量分数?
参考答案及评分标准(六)
一、二选择题(1~18小题每题4分,共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | B | B | A | D | C | C | D | BD |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | A | A | D | AC | CD | B | C | D | C |
19. ⑴ ① 铁圈向下倾斜 ② 铁置换出铜覆盖在铁圈上增重,银圈不反应(4分)
⑵ ① 银圈向下倾斜②铁圈和银圈形成原电池,铁圈作负极,银圈作阳极,银圈上析出铜增重。(4分) 本题共8分
20.⑴ A极 : 2H++2e -== H2↑ B极: 2Cl--2e- =Cl2↑(4分)⑵ L→J→K→A→B→M (2分)
⑶H接F,G接A,B接D,E接C(2分)⑷12.5, 2.5×1023 It(4分) 本题共12分
21. ⑴ >, HSO3- + H2O = H2SO3 +OH- HSO3- == SO32- + H+, HSO3-的电离强于水解,溶液显酸性。(4分) ⑵溶液红色褪去, HSO3-+2 OH-= SO32-+ H2O (2分)
|
⑶ 2NaHSO3 + 2H2O == Na2SO4 + H2↑+H2SO4 (2分) 本题共8分
22.⑴C , B (4分)⑵B, (2分)负极: 2Cu-4e- =2Cu2+ 正极: 2H2O+O2+4e- ==4OH-(4分)
本题共10分
23. ⑴阴极: 2H++2e -== H2↑ 阳极: 2ClCH2COO--2e -== ClCH2CH2Cl+CO2 ↑(4分)
|
⑷E:
(2分) 本题共10分
24.⑴ ②④ (2分)⑵Ni(OH)2、 Cd(OH)2可溶于酸, 生成溶于水的Ni2+、、Cd2+、, 危害性更严重。(3分)
⑶锂是密度最小的金属, 等质量的锂比其它金属失去的电子多, 即比容量大。(3分)
|
25. 解: 电解的总方程式是Cu + 2H2O == Cu(OH)2 + H2↑ (3分)
2a mol a mol
失水 36a g。剩余溶液是饱和溶液,原溶液丧失部分也是饱和溶液。
ω(Na2SO4)= (m×142/322)/(m+36a)×100%=![]() % (4分)答: 略 本题共7分
% (4分)答: 略 本题共7分
26.解: n(Cu)=7.04g/64g·mol-1=0.11mol
铁极 Cu2++2e-=Cu n(e-)= 0.22 mol 粗铜极 Zn -2e-=Zn2+ Cu-2e-=Cu2+ (4分)
现溶液增重500.02g-500g=0.02g, 增重是由于溶解锌析出铜之故。
n(Zn)=0.02 mol, m(Zn)=0.02mol×65g/mol=1.3g (4分)
电解时电子转移守恒:
0.02mol×2+n(Cu) ′×2 = 0.22 mol n(Cu) ′==0.09 mol (4分)
ω(Zn)= 1.3g/(1.3g+0.09mol×64g·mol-1)×100%=18.4%(2分) 答: 略本题共14分