高三化学同步测试(7)—卤素氧族
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分150分,考试用时120分钟。
可能用到的相对原子质量(原子量):
H-1 C-12 O-16 N-14 Ca-40 K-39 Mn-55 Br-80 S-32 Cl-35.5
第Ⅰ卷(选择题,共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有1个选项符合题意)
氰化钠系剧毒物品,只需 0.1g~0.3g既可致人死命。 2001年11月 1日下午 2时,在洛阳市洛宁的一场交通事故中,11吨氰化钠顺润河径直流入洛河,洛河河水氰化钠超标达300倍,受污染的水以每秒钟3000立方米的流量顺流而下,严重威胁着洛河沿岸数百万人民群众的生命财产安全。当地政府迅速采取截河堵水,并设法调集大量次氯酸钙、次氯酸钠、生石灰进行消毒。已知 NaCN水解生成剧毒且易挥发的弱酸HCN(结构式:H-C≡N),通过阅读上述材料回答下列1~2题:
1.在NaCN中,碳元素的化合价为 ( )
A.+1 B.+2 C.+3 D.+4
2.进行消毒时,可向水中投入一定量生石灰使污染水呈碱性,再加漂白粉、次氯酸钠。漂白粉、次氯酸钠的作用是 ( )
A. 可使污水漂白变成无色澄清
B.可将氰化钠凝固以防止扩散
C.可将氰化钠氧化为碳酸盐和氮气
D.可将氰化钠还原为炭和氨气
3.当不慎有大量氯气逸出到周围空间时,可以用浸有某种物质的一定浓度的水溶液的毛巾捂住鼻子,该物质最适宜采用的是 ( )
A.NaOH B.NaCl
C.KBr D.Na2CO3
4.氯胺H2NCl是常用的消毒杀菌剂,主要因为它能水解产生具有显著氧化性的物质,其水解的两种产物应是 ①NH4Cl②HCl③NH4ClO④NH3⑤HClO中的 ( )
A.①② B.②③ C.④⑤ D.③④
5.氯化碘(ICl)的化学性质跟Cl2相似,预计它跟水反应的最初产物是 ( )
A.HI和HClO B.HClO3和HIO
C.HCl和HIO D.HClO和HIO
6.在下列四种溶液中,分别加入少量固体MnO2,能产生气体的是 ( )
A.3%H2O2溶液 B.lmol/LNaOH溶液
C.lmol/L KClO3溶液 D.lmol/L盐酸
7. 甲、乙、丙三种溶液各含有一种X( X一为Cl一、Br一或 I一)离子,向甲中加淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化。则甲、乙、丙依次含有( )
A.Br一、Cl-、I- B.Br一、I一、Cl-
C.I一、Br一、Cl一 D.Cl一、I一、Br-
8. HCl的甲苯溶液、下列说法正确的是 ( )
A.能导电 B.与大理石作用产生气体
C.与锌作用产生氢气 D.通入NH3产生白色沉淀
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有1或2个选项符合题意。若正确答案只包括一个选项, 多选时, 该题为0分; 若正确答案只包括两个选项, 只选一个且正确的给2分, 选两个都正确的给4分, 但只要选错一个, 该小题就为0分)
9.在 0℃101kPa下,下列哪组气体混合后得到的气体其平均相对分子质量可能达到 50( )
A.O2、F2 B.HF、C12
C.F2、HCl D.HI、C12
10.将淀粉碘化钾混合液装在半透膜袋中,浸泡在盛有蒸馏水的烧杯中,过一段时间后,取烧杯中液体进行实验,能证明半透膜有破损的是 ( )
A.向烧杯中加入碘水变蓝色
B.向烧坏中加入碘水不变蓝色
C.向烧杯中加入AgNO3产生黄色沉淀
D.向烧杯中加入氯水变蓝色
11.C12通入石灰乳中得漂白粉,其主要成分可写成为 Ca(OH)2·3CaCl(ClO)·nH2O。过量HCl和漂白粉作用生成Cl2的质量和漂白粉质量之比称为“有效氯”。现有一种漂白粉的“有效氯”为35%,若该漂白粉的组成和上述化学式相符,则式中 n值应为( )
A.6.5 B.8 C.8. 5 D.10
12.钛被誉为“未来钢铁”、“太空金属”,原因是它的强度大,密度小,抗腐性能好,室温下,它不与水、稀盐酸、稀H2SO4、稀HNO3作用,但易溶于氢氟酸,推测其原因是( )
A.氢氟酸的酸性比其它酸强
B.氢氟酸的氧化性比其它酸强
C.氢氟酸的还原性比其它酸强
D.钛离子易与氟离子形成可溶性难电离物质
13.微量硒元素对人体有保健作用,已知硒与氧同主族,与钾同周期,下列有关硒元素的性质描述错误的是 ( )
A.硒既能溶于盐酸又能溶于烧碱溶液
B.硒的非金属性比溴弱,
C.硒的最高价氧化物的化学式为SeO3
D.硒的气态氢化物的化学式为 H2Se
14.在BaCl2溶液中通入SO2,溶液仍澄清,若将BaCl2溶液分盛两支试管,一支加硝酸,另一支加烧碱溶液,然后再通入SO2,结果两试管都有白色沉淀。下列结论合理的是( )
A.BaCl2 有两性
B.两支试管的白色沉淀均为Ba SO3
C.SO2有还原性和酸性
D.升高pH使SO2水溶液中SO32一浓度增大。
15.3a%的H2SO4溶液与a%的H2SO4溶液等体积混合,则混合溶液的质量分数是 ( )
A.等于2a% B.小于2a%
C.大于2a% D.无法确定
16.医学上常给病人口服 Na131 I溶液来诊断甲状腺疾病。这是由于合成甲状腺激素的重要原料是 ( )
A. 钠 B.碘 C.铁 D.钙
17.标准状况下 H2和 Cl2的混合气体 aL,经光照反应后,所得气体恰好使浓度为c mol/ L的 NaOH溶液 VL中的NaOH完全转化成盐,下列关系不可能的是 ( )
A.cV=a/22.4 B.cV<a/22.4
C.cV>a/11.2 D.a/11.2>cV>a/22.4
18.为缓解华北地区的旱情,有关部门选择适宜的条件和方法,向大气中发射催雨剂,其主要成分是干冰、液氮、碘化银等。下列有关叙述不正确的是 ( )
A.干冰和液氮的固体都是分子晶体
B.干冰和液氮的分子中都有非极性共价键
C.干冰和液氮催雨的原理属于物理变化
D.碘化银微粒在冷云中产生冰晶,起到催雨作用
第II卷 (非选择题 满分78分)
三、本题包括2小题, 共20分
19. (本小题共10分)已知硫代硫酸钠(Na2S2O3)具有①还原性:2 Na2S2O3+I2= Na2S4O6+2NaI ②在酸性条件下能迅速分解:Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O;③BaS2O3难溶于水。市售硫代硫酸钠固体中常含有硫酸钠,利用硫代硫酸钠跟I2反应的性质可定量测定市售硫代硫酸钠的纯度。现取Wg硫代硫酸钠固体样品配制成V mL的溶液,加入指示剂,用含I2为a mol/L的碘水进行滴定,耗用碘水b mL。回答下列问题:
A.该滴定实验最好是在__________(填“强酸性、中性、强碱性”)溶液中进行,理由是_________________________________________________________________________。
B.滴定过程中指示剂应选用_______________________溶液。
C.样品中硫代硫酸钠纯度的表达式是_____________________。
20.(本小题共10分) 过氧化氢(H2O2)又称双氧水,也称其为绿色氧化剂。为了贮存、运输、使用的方便,工业上采用“醇析法”将其转化成固态的过碳酸钠晶体(其化学式为2Na2CO3·3H2O2),该晶体具有 Na2CO3和 H2O2的双重性质。“醇析法”的生产工艺过程如下:
在0-5℃下,往饱和的Na2CO3溶液中,先加入H2O2和稳定剂(MgC12和Na2SiO3)经充分反应后,再加入异丙醇,过滤分离,即得过碳酸钠晶体。根据以上材料,回答下列问题:
(1)写出H2O2的结构式:_______________。
(2)H2O2被称为绿色氧化剂的主要原因是____________________________________。
(3)稳定剂能反应生成难溶物将过碳酸钠粒子包裹住,写出稳定剂反应生成难溶物的化学方程式:_____________________________________________
(4)加入异丙醇的作用是____________________________________。
(5)下列物质不会使过碳酸钠失效的是______________________。
A. MnO2 B.NaHCO3 C.H2S D.CH3COOH
四、本题包括2小题, 共20分
21. (本小题共9分)(1)用过量的锌与浓 H2SO4反应,某同学认为除了生成SO2外,还有H2产生。理由是____________________________________________________________。
(2)用过量的铜片与0.2mol浓H2SO4共热足够长时间(只考虑铜与H2SO4反应,忽略其它副反应)。甲认为产生的SO2等于0.1mol,理由是______________________________,
而乙同学认为产生的SO2小于0.1mol,理由是__________________________________。
你认为______同学正确。
(3)工业制取CuSO4不是直接用铜和浓H2SO4反应,而是将Cu和少量Ag的混合物漫在稀H2SO4中,并不断从容器下部吹入细小的空气泡,这样做的优点是________
①不产生污染大气的SO2②提高H2SO4的利用率③节省能源④提高铜的利用率
22.(本小题共11分) 氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,产生比它的酸性更强的含氧酸,同时放出气体,该气体混合物经干燥后,平均分子量为47.6,它可以使带火星的木条复燃,并可使润湿的淀粉一碘化钾试纸变蓝后又褪色。试完成下列各题:
(l)该气体的组成是___________,气体混合物的物质的量比为_______________。
(2)写出氯酸分解方程式并配平______________________________________________。该反应的还原产物是_________________________(写化学式)。
(3)结合化学反应方程式解释,该气体使润湿的淀粉一碘化钾试纸变蓝后又褪色的原因:
______________________________,____________________________________。
五、本题包括2小题, 共16分
23.(本小题共10分)
通Cl2 通空气 用Na2CO3溶液吸收Br2 稀硫酸
![]() 海水 → →
→ NaBr和NaBrO3溶液 → Br2
海水 → →
→ NaBr和NaBrO3溶液 → Br2
① ② ③ ④
(1)写出步骤①、③、④的离子方程式________________________________
______________________________________,_________________________________
(2)经步骤④后,从溶液中获得纯溴的方法是_________________________。
(3)若海水中c(Br-)=2 × 10-3mol/L则理论上每 lm3海水(ρ=1g/cm3)能制得_________g溴。
24.(本小题共6分) 在一定条件下, 下列各物质可发生如下图所示的变化(反应中生成的水没有写出)
过量F
 →溶液C → 溶液B → 焰色反应黄色
→溶液C → 溶液B → 焰色反应黄色
液体x (I)
固体A
→气体D 液体x
→ H → 溶液E
→气体F ↑
E溶液 溴水(II) ↓
固体B 溶液L
→溶液G
请回答:
(1)固体A是(写化学式)__________________________
(2)反应(I) 的化学方程式 ________________________________________
(3)反应(Ⅱ) 的化学方程式 ________________________________________
六、本题包括2小题, 共22分
25. (本小题共10分) 将一定量的氯酸钾和高锰酸钾的固体混合物充分加热,得到1792mL气体(标况)。将剩余的固体分离(不考虑损耗),所得的黑色固体在强酸性条件下正好把分离得到的氯化物全部氧化。问原混合物中氯酸钾和高锰酸钾各多少克?
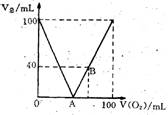 26. (本小题共12分) 已知H2S在O2足量的条件下燃烧生成SO2和水、在O2不足的条件下燃烧生成S和水。现标准状况下。将100mLH2S和O2的混合气体点燃,恢复到原来状况。发现随混合气体中O2所占体积V(O2)的变化,反应后所得气体总体积V(总)也在变化,如右图所示。(1)写出A、B两点横坐标值及化学方程式:
26. (本小题共12分) 已知H2S在O2足量的条件下燃烧生成SO2和水、在O2不足的条件下燃烧生成S和水。现标准状况下。将100mLH2S和O2的混合气体点燃,恢复到原来状况。发现随混合气体中O2所占体积V(O2)的变化,反应后所得气体总体积V(总)也在变化,如右图所示。(1)写出A、B两点横坐标值及化学方程式:
A点值_______,
A处方程式____________________________;
B点值_______,
B处方程式____________________________。
(2)填表(气体体积单位:mL)
| V(总) | V(O2)范围值 | V(总) 中气体成分 |
| ①大于40 | ||
| ②小于40 | ||
| ③等于40 | ||
参考答案及评分标准(七)
一、二选择题(1~18小题每题4分,共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | C | D | C | C | A | B | D | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | AD | C | D | A | CD | C | B | C | B |
19. A. 中性, 在强酸中发生 Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O ; 在强碱中发生2NaOH+I2==NaI+NaIO+H2O (5分)B. 淀粉(2分)C.(31.6ab/W)% (3分) 本题共10分
20.⑴ H—O—O—H (2分)⑵H2O2具较强的氧化性, 其还原产物是H2O, 对环境无污染。(2分)⑶ MgCl2 +Na2SiO3=MgSiO3↓+2NaCl (2分) ⑷减小过碳酸钠的溶解度, 促使过碳酸钠的析出(2分)⑸ C(2分) 本题共10分
21. ⑴浓硫酸与锌反应生成SO2, 随着反应的进行硫酸浓度逐渐变稀, 稀硫酸与锌生成氢气。(2分) ⑵铜片过量, 浓硫酸与铜完全反应, 由方程式可知生成SO20.1mol(2分);随着反应的进行硫酸浓度逐渐变稀, 稀硫酸不与铜反应, 生成SO2小于0.1mol(2分);乙 (1分) ⑶ ①②③(2分) 本题共11分
22.⑴ Cl2 O2 2:3 (4分)⑵8HClO3 == 2Cl2↑+3O2↑+4HClO4+2H2O;Cl2 (3分)
⑶ Cl2 +2KI=2KCl+I2 I2 与淀粉显蓝色, Cl2 + H2O =HCl+ HClO HClO具漂白性。(4分)本题共11分
23. ⑴ ① 2Br-+ Cl2 =Cl-+Br2 ③3Br2+3CO32-=5 Br-+BrO3-+3CO2↑
④ 5 Br-+BrO3-+6H+ = 3Br2 +3 H2O(6分) ⑵萃取 (2分)⑶ 160 g(2分) 本题共10分
24. ⑴Na2O2 ⑵ NaOH +SO2=NaHSO3 ⑶Br2 +SO2+2 H2O=2HBr +H2SO4(6分)
25. 解: 设分解的KMnO4的物质的量为x, 分解的KClO3的物质的量为y
|
|
2KMnO4 == K2MnO4 + MnO2+ O2 2KClO3 ==2KCl +3O2 ↑
x 0.5x 0.5x y y 1.5y
|
MnO2 +4H+ +2Cl- == Mn2++ Cl2 ↑+ 2H2O
0.5x y
![]() 0.5x×2=y
0.5x×2=y
(0.5x+1.5y)×22.4L/mol=1.792L 解得 x=y=0.040mol(6分)
m(KMnO4)=6.32g m(KClO3)=4.90g(4分)
答: 略 本题共10分
26.解: ⑴A点表示气体的体积为0
2H2S+O2=2S+2H2O V(O2)=33.3mL(3分)
B点表示O2过量, 将有SO2 生成, 利用元素守恒
(40+x) H2S+(60-x)O2 =xS+ 40SO2+(40+x) H2O
(60-x)×2=40×2+40+x x=0 说明恰好燃烧生成SO2
方程式是: 2H2S+3O2 = 2SO2+2H2O V(O2)=60mL (3分)
⑵①V(总)>40 Ⅰ左边线段:, 剩余气体是H2S
2H2S+O2=2S+2H2O V(O2)=(100mL-40mL)/3=20mL范围: 0<V(O2)<20mL
Ⅱ右边线段, 气体是SO2 、O2, 利用差量法
2H2S+3O2 = 2SO2+2H2O V(O2) =100mL-40mL =60mL范围: 60mL<V(O2)<100mL
②V(总)<40 Ⅰ左边线段: 剩余气体是H2S 范围: 20mL<V(O2)<33.3mL
Ⅱ右边线段, 气体是SO2 范围: 33.3mL<V(O2)<60mL
| V(总) | V(O2)范围值 | V(总) 中气体成分 |
| ①大于40 | 0<V(O2)<20mL | H2S |
| 60mL<V(O2)<100mL | SO2 、O2 | |
| ②小于40 | 20mL<V(O2)<33.3mL | H2S |
| 33.3mL<V(O2)<60mL | SO2 | |
| ③等于40 | V(O2)=20mL | H2S |
| V(O2)=60mL | SO2 |
(6分)
答: 略 本题共12分