高三化学同步测试(8)—氮 碳族
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分150分,考试用时120分钟。
可能用到的相对原子质量(原子量):
H-1 C-12 O-16 N-14 C Fe-56 S-32 Cl-35.5
第Ⅰ卷(选择题,共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有1个选项符合题意)
1.高空中O2吸收紫外线可变成 O3,O3可分解:O3→O2+ O,O3又和大气污染物 NO发生反应NO+O3=NO2+O2, NO2+O= NO+O2,从反应过程和中间产物判断NO的作用是 ( )
A.氧化剂 B.还原剂 C.催化剂 D.干燥剂
2.第二次世界大战期间,某国的侦察小分队发现了德国法西斯一座十分隐蔽而且戒备森严的军火工厂,上级要求在三天内必须炸掉它,结果他们用十多只涂有化学试剂的老鼠完成了任务。据你推测这种化学试剂是 ( )
A.TNT B.KMnO4和H2SO4
C.黑火药和炸药 D.白磷的CS2溶液
3.洛阳东都商厦因电焊工违章操作,引发了震惊全国的12.25特大火灾。大火中309人丧生.主要是含高浓度CO、CO2及其它有毒物质的浓烟所致。当火灾发生时,采取的下列措施中不恰当的是 ( )
A.立即撤离火灾现场并拨打120报警
B.若逃生通道被堵,应迅速转移到窗口边或阳台上等待救援
C.若被困在室内,应立即封堵火、烟的进口,并站在室内最高处等待救援
D.若被困在火灾现场,应尽可能贴近地面向火热小,烟雾少的方向撤离。
4.下列说法错误的是 ( )
A.铅笔芯的主要原料是石墨,儿童在使用时不会引起中毒
B.一氧化碳有毒,生有煤炉的居室可放置数盆清水, 这样可有效地吸收一氧化碳,防止煤气中毒
C.“汽水”浇灌植物有一定的道理,其中二氧化碳的缓释, 有利于作物的光合作用
D.硅的提纯与应用,促进了半导体元件与集成芯片业的发展,可以说“硅是信息技术革命的催化剂”
5.我国科学前不久成功地合成了3mm长的管状碳纳米管,长度居世界之首。这种碳纤维具有强度高。刚度(抵抗变形的能力)高、密度小(只有钢的25%)、熔点高,化学稳定性好的特点,因此被称为“超级纤维”。下列对碳纤维的说法中不正确的是 ( )
A.它是制造飞机的理想材料
B.它的主要组成是碳元素
C.它的结构与石墨相似
D.碳纤维复合材料不易导电
6.下列反应起了氮的固定作用的是 ( )
A.氨经催化氧化生成 NO
B.NO与 O2反应生成 NO
C.N2在一定条件下与 Mg反应生成 Mg3N2
D.NH3与硝酸反应生成 NH4NO3
7.足量CO2气体通入下列溶液,最终无浑浊的是 ( )
A. 饱和 Na2CO3溶液 B.漂白粉溶液
C.NaAlO2溶液 D.水玻璃(Na2SiO3溶液)
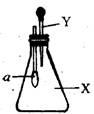 8.右图中,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液
8.右图中,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液
体Y滴入瓶中,振荡,一会可见小球a鼓气,气体X和液体y不可能是 ( )
A.氨气和水
B.SO2和NaOH浓溶液
C.CO2和稀硫酸
D.氯化氢和NaNO3稀溶液
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有1或2个选项符合题意。若正确答案只包括一个选项, 多选时, 该题为0分; 若正确答案只包括两个选项, 只选一个且正确的给2分, 选两个都正确的给4分, 但只要选错一个, 该小题就为0分)
9.已知亚磷酸(H3PO3)只能生成两种钠盐(NaH2PO3和Na2HPO3),由此可知下列说法中不正确的是 ( )
A.亚磷酸中磷+3价 B.亚磷酸有氧化性和还原性
C.亚磷酸是二元酸 D.亚磷酸只有两种酸式盐而无正盐
10.某金属和稀硝酸反应生成一种硝酸盐,该硝酸盐受热时分解生成NO2、O2和一种固体,则该硝酸盐分解产物中NO2和O2的物质的量之比不可能是 ( )
A.1:4 B.8:l
C.4:1 D.2:1
11.在同温同压下,把等体积的空气和 CO2混合,并使之在高温下跟足量的焦炭反应,若O2 和CO2最后全部转化为CO,则反应后气体中CO的体积分数为(空气中O2占20%)( )
A.0.40 B.0.60
C.0.70 D. 0.75
12.下列关于石英(SiO2)晶体的说法,不正确的是 ( )
A.晶体中键角都是109028′
B.晶体中有“SiO4”正四面体结构
C.每1个硅原子形成4个Si—O共价键
D.最小环由12个原子构成
13.若发现114号元素X,它的最外层电子排布与碳相同,比碳多5个电子层,则下列叙述正确的是 ( )
A.X有稳定的气态氢化物
B.X应为非金属元素
C.X的最高价氧化物为XO2
D.X的低价氧化物是酸性氧化物
14.某稀HNO3溶液中加入5.6g Fe粉,充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加 3.2g所得溶液中 Fe2+和 Fe3+物质的量之比是 ( )
A.1:1 B.2:1 C.3:2 D.4:1
15.在一定条件下.将物质的量相同的 NO和O2混合发生如下反应;2NO+O2 =2 NO2 2NO2 = N2O4(NO2转化率为60%),则混合气体的平均式量为 ( )
A. 6 B.51.7 C.49.6 D.4.3
16.将铜粉放入稀硫酸中,未发生反应,当加入一种晶体后,可观察到溶液显蓝色,同时有气体逸出,则该晶体是 ( )
A.FeC13 B.Na2 SO4·10H2O
C.Na2CO3 D.NaNO3
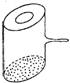 17.实验室里常见的如右图所示的仪器,该仪器为两头密封的玻璃窗,中间带有
17.实验室里常见的如右图所示的仪器,该仪器为两头密封的玻璃窗,中间带有
一根玻璃短柄。当玻璃管内装有感片时,用此仪器进行碘的升华实验,具有
装置简单、 操作方便、现象明显、可反复使用等优点。用此仪器不能反复进
行的实验是 ( )
A.NH4Cl受热分解的实验
B.KMnO4受热分解的实验
C.白磷和红磷在一定温度下相互转变的实验
D.无水CuSO4与胆矾的互变实验
18.某无色混合气体可能含有Cl2、O2、HCl、NH3、NO、NO2中的两种或多种,现将此混合气体经过浓硫酸后体积减小,将剩余气体排入空气中,很快变成红棕色。对于原混合气体成分的判断中,正确的是 ( )
A.肯定有O2 B.肯定没有Cl2、NH3、NO2
C.肯定有NH3、NO、HCl D.肯定只有NH3和NO
第II卷 (非选择题 满分78分)
三、本题包括2小题, 共22分
19. (本小题共10分) 某碳酸盐矿石(主要成分为BaCO3,亦有少量CaCO3),现需获得BaCO3,并尽可能降低CaCO3含量,为此,查得有关溶解度数据如下:
|
料。下图是实验步骤,试在箭头上的括号内注明
反应条件或方法或所需物质,并在各方框内写出
每步产物的化学式:
( ) ( ) ( ) ( )
![]()
![]()
![]()
![]() 矿石 → → → →
→
。其中所需一物质须另行制取,方程式是______________________________
矿石 → → → →
→
。其中所需一物质须另行制取,方程式是______________________________
20.(本小题共12分) 现用U型管(用硬质玻璃管弯制)、干燥管、酒精灯、胶塞和玻璃导管等仪器设计右图装置来证实稀硝酸与铜反应生成NO 。
(1)补充完成下列实验步骤:
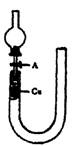 ①检查装置的气密性,方法是________________________________________
①检查装置的气密性,方法是________________________________________
_______________________________________________________________
②打开活塞A,从U形管长管一端注入稀硝酸,一直注到______________
__________________________________________________ 为止。
③关闭活塞A,用酒精灯在U型管短管一侧加热,当观察到_______________
________________现象时,立即停止加热, 原___________________________________。
(2)记录描述观察到的实验现象:
①可在U型管短管上方处观察到_________色气体产生。若铜丝和稀硝酸均未完全反应,在________________________________________________________________时反应也可自行停止。
②反应自行停止后,如果慢慢打开活塞A,可立即观察_________________________,
以上现象说明_____________________________________________________。
四、本题包括2小题, 共22分
21.(本小题共12分) 碳的稳定的氧化物除CO、CO2外,还有C3O2、C4O3、C5O2、C12O9等低氧化物,其中C3O2是一种在常温下有恶臭的气体,其分子中的每个原子都满足最外层8电子结构。假设在一定条件下 CH3COOH→CH2=C=O+H2O。
①C3O2分子的电子式为___________;
②在上述碳的低氧化物中,若有分子空间构型与 C3O2相同的,最可能是___________;
③不考虑反应条件,根据你现有的化学知识判断, O2、HCl能与 C3O2发生反应,请将能够反应的化学方程式写在下面。
_______________________________________,_____________________________________,
22.(本小题共10分) (1)将 1 L 1 mol/L 的纯碱溶液慢慢滴入1 L1.25 mol/L稀盐酸中;将1 L1.25 mol/L 稀盐酸慢慢滴入1 L1mol/L的纯碱溶液中。这两种操作产生的气体的体积比为_____________
(2) 三硅酸镁是一种胃病患者常用的制酸剂,该物质难溶于水,服用后能中和过多的胃酸。把三硅酸镁的化学式 Mg2 Si3O8·n H2O改写成氧化物的形式_________,写出它中和胃酸(主要是HCl)的化学方程式_______________________________________。
(3)在标准状况下,将 15.6 mL某氮的氧化物 NxOy与过量的氢气混合后反应生成氮气和水,若仍恢复至标准状况时,测得剩余气体的体积比原来缩小了46.8mL,通过计算确定该氧化物的分子式__________________。
五、本题包括2小题, 共17分
23.(本小题共7分) 下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸。当X无论是强酸还是强碱时都有如下转化关系:
X Y Y Z
A → B → C → D → E
当X是强酸时,A、B、C、D、E均含有同一种元素;当X是强碱时,A、B、C、D、E均同时含有另一种元素。回答下列问题:
(1)A是______,Y是_________,Z是_____________。
(2)当X是强碱时,E是___________;当X是强酸时,E是________________。
(3)写出A与X反应的离子方程式__________________________________。
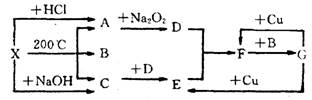 24.(本小题共10分) 右图表示的反应关
24.(本小题共10分) 右图表示的反应关
系中,部分产物被略去,X为l mol
固体,A、B、C各为l rnol无色气体,
B在常温下为液体,D、E、F为气体,
G为液体。则(1) 写出化学式 X_________,C___________。
(2) 写出化学方程式
A→D_____________________________
F→G_____________________________
(3) 实验室需测定F的式量, 测出的数据常比理论值大。其原因是____________________
___________________________________________(用方程式和必要的文字说明)
(4) 工业上合成C, 常用反应物___________和___________,合成后采用_________方法分离出_____________,能分离出该物质的原因是__________________________________。
六、本题包括2小题, 共17分
25.(本小题共5分) 将一小块质量为 w g的焦炭和n g O2同时放入一个装有压力表的密闭容器中,压力所示为p0,当容器内充分发生反应后,恢复至原温度,压力表所示为p1 。如果pl是po的m倍(m>1),则w应满足的关系式是____________________,m的最大值是 _______。
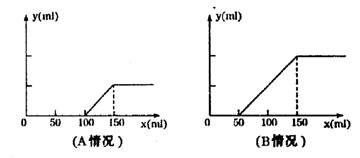 26.(本小题共12分) 分别取等物
26.(本小题共12分) 分别取等物
质的量浓度的氢氧化钠溶液
各100ml,再通入一定量的
CO2,随后分别各取20mL溶
液,向其中逐滴滴入0.2mol/L
的盐酸,在标准状况下产生
CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如下图(分A.B两种情况):
(1)在A情况下,溶质是(填化学式)___________,其物质的量之比为_______________。
(2)在B情况下,溶质是(填化学式)____________,其物质的量之比为_______________。
(3)在A、B两种情况下产生CO2的最大体积各为___________mL和_____________mL
(4)原氢氧化钠溶液的物质的量浓度为:______________________。
参考答案及评分标准(八)
一、二选择题(1~18小题每题4分,共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | D | B | B | C | C | B | B | D |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | CD | D | A | C | C | B | D | B | D |
|
|
|
|
|
|
![]()
|
|
(8分)
|
|
|
C+ H2O==CO+H2↑ CO + H2O===== CO2+H2 (CO+ O2== CO2 ) (2分) 本题共10分
20.(1) ①关闭活塞A, 向U型管中加水至右端水面高于左端, 静止观察右端水面是否下降, 如下降气密性差,否则气密性好 (2分)②铜丝完全浸没于硝酸溶液中(2分)③有气泡逸出, 左端液面下降;该反应是放热反应(2分)
|
21. ① :O::C::C::C::O: (3分)② C5O2 (3分) ③ C3O2 +2O2==3CO2(3分)
O=C=C=C=O+2HCl→ClCOCH2COCl (3分) 本题共12分
22.⑴5:2 (3分)⑵2MgO·3SiO2·n H2O (2分) Mg2Si3O8·n H2O +4HCl=2MgCl2+ 3SiO2+(n+2)H2O(3分)⑶N3O2 (2分) 本题共10分
|
(2) HNO3 H2SO4 (2分)⑶ S2-+2H+=H2S NH4++OH- = NH3 ↑+ H2O (2分)
本题共7分
|
(3) 2NO2 N2O4 , 在NO2中混有N2O4测定式量大于理论式量。(3分)
(4)N2 H2 , 加压降温液化, NH3分子之间存在氢键, 作用力大,易液化。(3分)
本题共10分
25. 解: 气体压强正比于气体的物质的量
|
|
C(s)+O2(g) === CO2 (g) 2C(s)+O2 (g) === 2 CO (g)
m>1, 气体中应用CO2、CO 或CO p0 ∝ n/32 p1 ∝ n(CO2)+n(CO)
n(CO2)+n(CO)= p1×n/ p0×32=mn/32 n(C)= n(CO2)+n(CO)= mn/32
W(C)= 12×mn/32=3mn/8 m(max)=2 (5分) 答: 略
26. 解: NaOH与CO2反应后溶液有下列4种情况
①NaOH Na2CO3 ②Na2CO3 ③Na2CO3 NaHCO3
④NaHCO3有关反应: NaOH+HCl==NaCl+H2O
Na2CO3+HCl==NaCl+ NaHCO3 HCl + NaHCO3 = CO2 ↑+NaCl+H2O
(1)生成气体消耗HCl的体积小于生成气体前消耗HCl的体积, 且体积比为1:2
原溶液是NaOH 、Na2CO3 且物质的量之比为1:1 (3分)
(2)生成气体消耗HCl的体积大于生成气体前消耗HCl的体积, 且体积比为2:1
原溶液是Na2CO3 NaHCO3且物质的量之比为1:1 (3分)
(3)A情况: V(CO2)=50mL×0.2mol·L-1×10-3L·mL-1×22.4 L·mol-1 =0.224L=224mL
B情况: V(CO2)=100 mL×0.2mol·L-1×10-3L·mL-1×22.4 L·mol-1=0.448L=448mL(4分)
(4)A情况: HCl的体积50mL时, 溶液是NaCl溶液
c(NaOH)=0.150L×0.2mol·L-1/0.1L=0.30mol/L(2分)
答: 略 本题共12分