高三化学练习
一、选择题(每小题只有一个正确答案)
1.用NA表示阿佛加德罗常数,下列说法不正确的是( )
A.标准状态下的辛烷22.4L完全燃烧产生CO2分子数为8NA
B.18g水中所含电子个数为10 NA
C.46gNO2和46gN2O4中所含原子数均为3 NA
D.1L 2mol·L-1的Mg(NO3)2溶液中含NO3-个数为4 NA
2.下列物品的用途与新型无机非金属材料无关的是( )
A.切割玻璃的刀 B.用于通讯的光缆
C.钟表的轴承 D.普通玻璃
3.水资源非常重要,联合国确定2003年为国际淡水年。下列关于水的说法中错误的是 ( )
A、市售的纯净水中矿物离子的含量相对较少
B、淡水的密度小于海水的密度
C、融化的雪水中矿物质含量比深井水中的少
D、0℃以上,温度越高,水的密度越小
4.咖喱是一种烹饪辅料,若沾到白色衬衣上,用普通肥皂清洗,黄色污渍变成红色,经水漂洗后红色又恢复到黄色,据此现象,你认为咖喱汁与下列何种试剂可能有相似的化学作用( )
A.品红溶液 B.石蕊试液
C.氯水 D.KI淀粉溶液
5.下列各组物理量中,都不随取水量的变化而变化的是 ( )
A、水的沸点;蒸发所需热量
B、水的密度;水中通入足量CO2后溶液的PH值
C、水的体积;电解水所消耗的电量
D、水的物质的量;水的摩尔质量
6.某地区的地表层存在大量KNO3、Na2SO4·10H2O等矿物,你认为该地区的气候特点是( )
A.干旱 B.多雨 C.旱季雨季分明 D.洪涝
7.在F、P、Si、Fe这四种元素中,每种元素都有某些方面区别于其它三种元素,若从中选出氟元素,选择的理由中正确的是( )
A、最高价氧化物对应的水化物酸性最强
B、单质与冷水反应最剧烈
C、单质固态时为分子晶体,熔沸点较低
D、在氧化物:OF6 、P2O5 、Fe2O3 中,OF6最稳定
8.下列离子反应方程式正确的是( )
A、用Zn和醋酸反应来制取H2 Zn + 2H+ = Zn2+ + H2↑
B、实验室制取NH3 NH4++OH- = NH4OH↑
C、尾气H2S用CuSO4溶液吸收 H2S + Cu2+= CuS↓+2H+
D、向漂白粉溶液中滴入少量的Na2SO3溶液 Ca2+ +SO32- = CaSO3↓
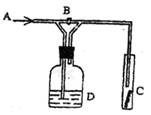 9、右图是对某气体化学性质的实验装置,如打开B,
9、右图是对某气体化学性质的实验装置,如打开B,
从A处通干燥的氯气,C中干燥的红色布条无变
化,如关闭B,C中干燥的红色布条褪色,则D
中所装溶液是 ( )
A.浓H2SO4 B.饱和NaCl溶液
C.NaOH溶液 D.NaBr溶液
10.从20世纪20年代起,就有人预言可能存在由4个氧原子构成的氧分子,但一直没有得到证实。最近,意大利一所大学的科学家使用普通的氧分子和带正电的氧离子制造出了这种新型氧分子,并用质谱仪探测到了它存在的证据,若该氧分子具有空间对称结构,你认为该氧分子是( )
A、氧元素的一种同位素 B、臭氧的同分异构体
C、一种新的氧化物 D、可能是非极性键构成的非极性分子
11.![]() 溶液与
溶液与![]() 溶液等体积混合,混合后溶液中离子浓度关系表述正确的是( )
溶液等体积混合,混合后溶液中离子浓度关系表述正确的是( )
A.![]()
B.![]()
C.![]()
D.![]()
12.酸根RO3―所含的电子数比硝酸根NO3―的电子数多10,则下列说话正确的是( )
A、R原子的电子层数比N的电子层数少1
B、RO3―中R的化合价与NO3―中N的化合价相等
C、RO3―和NO3―只能被还原,不能被氧化
D、R和N为同族元素
![]() 13.在一定条件下,向密闭容器中按5∶4的体积比充入一氧化碳和水蒸气进行反应,当CO(g) + H2O(g) CO2(g) + H2(g)
达到平衡时,水蒸气与氢气的体积分数相等,则下列叙述中错误的是( )
13.在一定条件下,向密闭容器中按5∶4的体积比充入一氧化碳和水蒸气进行反应,当CO(g) + H2O(g) CO2(g) + H2(g)
达到平衡时,水蒸气与氢气的体积分数相等,则下列叙述中错误的是( )
A.平衡时一氧化碳的体积分数为33.3%
B.平衡时水的转化率为50%
C.平衡时一氧化碳的转化率为45%
D.平衡时混合气体的平均相对分子质量约为23.6
14.在氯化铁和氯化铝的混合溶液中,先加入过量的碘化钾溶液,再加入足量的硫化钠溶液,所得沉淀是( )
A、Al2S3和I2 B、Fe(OH)3和Al(OH)3
C、Fe2S3和I2 D、FeS、Al(OH)3和S
15.1.92g Cu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672ml气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为 ( )
A.504 mL B.336 mL C.224 mL D.168 mL
二、填空题
16、麻醉剂的发现和使用,是人类医疗史上了不起的一项成就,它可使患者在接受治疗时感觉不到疼痛。
(1)笑气是人类最早应用于医疗的麻醉剂之一,它可由![]() 在微热条件下分解产生,产物除
在微热条件下分解产生,产物除![]() 外还有一种,此反应的化学方程式为______________________,标出电子转移的方向和数目。有关理论认为
外还有一种,此反应的化学方程式为______________________,标出电子转移的方向和数目。有关理论认为![]() 与
与![]() 分子具有相似的结构(包括电子式),已知
分子具有相似的结构(包括电子式),已知![]() 分子中氧原子只与一个氮原子相连,则
分子中氧原子只与一个氮原子相连,则![]() 的电子式可表示为____________,其空间构型是__________型。
的电子式可表示为____________,其空间构型是__________型。
(2)另一种常用麻醉剂氯仿,常因保存不慎而被氧化,产生剧毒物光气![]() :
:![]() +
+![]()
![]() 2HCl+
2HCl+![]() ,为了防止事故,使用前可用于检验氯仿是否变质的试剂是_________________。
,为了防止事故,使用前可用于检验氯仿是否变质的试剂是_________________。
A.淀粉一碘化钾溶液 B.![]() 溶液
溶液
C.酚酞溶液
D.硝酸酸化的![]() 溶液
溶液
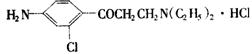 (3)氯普鲁卡因盐酸盐是一种局部麻醉剂,麻醉作用较快,较强,毒性较低,其结构简式为
,它可以以甲苯为原料,先经过
(3)氯普鲁卡因盐酸盐是一种局部麻醉剂,麻醉作用较快,较强,毒性较低,其结构简式为
,它可以以甲苯为原料,先经过
_____________反应合成
,再经过________________反应来合成![]() ,再经过一系列反应来合成。(填反应类型)
,再经过一系列反应来合成。(填反应类型)
(4)作为麻醉剂,氙气在医学上也很受重视,氙能溶于细胞质的油脂里,引起细胞的麻醉和膨胀,从而使神经末梢作用暂时停止。人们曾试用体积分数为80%的氙气和20%的氧气组成的混合气体作为无副作用的麻醉剂,氙在元素周期表中位于__________周期,__________族,此麻醉剂的平均式量为__________________。
17.请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:(12分)
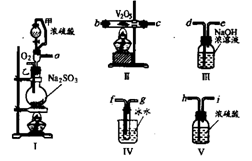 |
(1)这些装置的连接顺序(按气体从左到右的方向)是:
![]()
![]()
![]()
![]()
![]()
![]()
![]() (填各接口的编号)
(填各接口的编号)
(2)实验时甲仪器的作用与原理是
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时I处滴入浓硫酸与II处加热 催化剂的先后顺序是 。
(4)IV处观察到的现象是 。
(5)在I处用大火加热烧瓶时,SO2的转化率会 (填“增大”、“不变”或“减小” )
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得III处增重mg,则本实验中SO2的转化率为 。
18.(10分)A.一种无色气体X与红热的碳反应得到无色气体Y,Y与CuO反应又可得X,则X是 Y是 或X是 Y是
B.盐酸、硫酸和硝酸是三种重要的酸。
(1)工业上生产盐酸与硝酸时,都要用到的气态反应物是_______
;
(2)工业上生产硫酸与硝酸时,用到的相同的重要设备是_______
;
(3)工业生产中欲制得高浓度的硫酸与硝酸,可使用的相同物质是_______
;
(4)浓盐酸与浓硝酸暴露在空气中,相同的现象是_______
;
(5)浓硫酸与浓硝酸都可用铁、铝容器贮存的相同原理是_______
;
(6)实验室制备H2、CO2、H2S、SO2时,用盐酸和浓硫酸可制备的相同气体是_______。
19、在星际云中发现一种高度对称的有机分子Z,在紫外辐射或加热下可转化为其它生命前物质,这些事实支持了生命来自星际的假设。有人认为,Z的形成过程如下:
已知NH3、RNH2、R2NH均可以与RCH2OH发生脱水缩合反应。
(1)写出X、Y和Z的结构简式。
(2)X的一氯代物有几种,二氯代物有几种?
20、熔融碳酸盐燃料电池(MCFS),发明于1889年,上世纪的30~60年代在荷兰得到广泛的发展,而且建成了寿命超过40000小时的电池,可应用于中心电站。
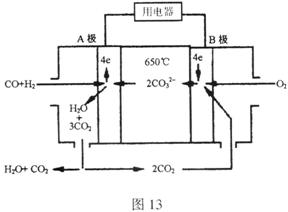 现有一个碳酸盐燃料电池,以一定比例
现有一个碳酸盐燃料电池,以一定比例![]() 和
和![]() 低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、
低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、![]() )直接作燃料,其工作原理如图所示。
)直接作燃料,其工作原理如图所示。
请回答下列问题:
(1)B极为_________极,发生_________(填“氧化”或“还原”)反应,该极发生的电极反应为________________________________;
(2)电池总反应为___________________________________________。
三、计算题
21、将标准状况下一定体积![]() 气体缓慢通入V LNaOH溶液中,结果
气体缓慢通入V LNaOH溶液中,结果![]() 和NaOH均无剩余。在反应后的溶液中加入足量的石灰水得到W g沉淀。
和NaOH均无剩余。在反应后的溶液中加入足量的石灰水得到W g沉淀。
(1)能否用以上数据确定![]() 的体积?若能,请列式表示。若不能,还需做什么实验?简要说明并运用实验测得的数据列式表示。
的体积?若能,请列式表示。若不能,还需做什么实验?简要说明并运用实验测得的数据列式表示。
(2)能否确定NaOH溶液的物质的量浓度?若能,请列式表示。若不能,还需做补充什么实验?简要说明并运用实验测得的数据列式表示。
22.甲醇是一种重要的醇,它可以做内燃机的燃料和溶剂,也是一种重要的化工原料,同时它在废水处理中也有重要应用。
(1)在25℃时1g甲醇完全燃烧后恢复至原温度时可放出24.2kJ热量,则25℃时1mol甲醇完全燃烧生成100℃时CO2和水蒸气应放出 kJ热量。(保留整数)(有关热量公式Q=m·C·△t Q=m·J, 已知水的比热
C=4.18J·g-1·℃-1,水的液化热J=2253J·g-1 m:物质质量 △t:温度差
假设100℃时水完全汽化,并忽略CO2吸热)
(2)甲醇加入含氨的废水中,在一种微生物作用下发生反应:
2O2+NH3=NO3-+H++H2O, 6NO3-+6H++5CH3OH→3N2↑+5CO2↑+13H2O
若某废水用上述方法处理时,NH3→NO3-的转化率为95%,NO3-→N2的转化率为86%。若每天处理此种含NH3为34mg/L的废水500m3(密度1g/cm3)需要甲醇多少千克?(要求写出解题步骤,保留至小数点后一位)
选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| A | D | D | B | B | A | B | C | B | D | A | B | C | D | B |
填空题
16、(1)![]() ↑
↑![]() ;∶
;∶![]() ∶∶N∶∶
∶∶N∶∶![]() ∶; 直线;
∶; 直线;
(2)D (3)硝化(取代)、氧化 (4)五、O、111.2
17、(1)a→h→i→b→c→f→g→d
(2)保持分液漏斗内压强与烧瓶内相同,使液体顺利滴下
(3)先加热后滴入浓硫酸 (4)析出无色晶体
(5)
(6)![]() %
%
18、A.X:CO2 Y:CO 或 X:H2O Y:H2
B.(1)H2 (2)吸收塔(3)浓H2SO4(4)白雾(5)钝化(6)SO2
19、(2)2种;5种
20、(1)正极,还原,O2 +2CO2-4e-=2 CO32-
(2)2CO + O2 =2CO2 O2+ 2H2 =2H2O
21、(1)能,0.224W(2)不能
22、(1)682;
(2)解:由反应2O2+NH3=NO3-+H++H2O,
6NO3-+6H++5CH3OH→3N2↑+5CO2↑+13H2O
得关系式:6NH3—6NH3-—5CH3OH—3N2↑
![]()
![]() 根据关系式6NH3
5CH3OH
根据关系式6NH3
5CH3OH
6mol 5×32×10-3kg
1000mol×95%×86% m(CH3OH)
![]()
答:消耗甲醇21.8kg