高三化学模拟试题
原子量:H—1、O—16、N—14、S—32、Na—23、K—39、Mg—24、Al—27、Fe—56、Cu—64
一、选择题(每题只有1个正确答案)
1、只含有一种元素的物质( )
A、可能是纯净物,也可能是混合物 B、可能是单质,也可能是化合物
C、一定是纯净物 D、一定是一种单质
2、实现下列变化时需克服相同类型作用力的是( )
A、石墨和干冰的熔化 B、食盐和冰醋酸的熔化
C、液溴和水的汽化 D、碘和荼的升华
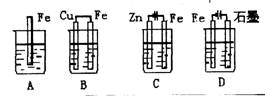
3、下列各容器中盛有海水,铁的腐蚀速率最快的是( )
4、有下列变化:①木材干馏;②从煤焦油中提取苯和苯的同系物;③将溴水滴入CCl4中,振荡后褪色;④制肥皂时加食盐盐析得肥皂;⑤加热NH4Cl固体,在试管上部又出现白色固体;⑥纯碱晶体风化。其中属于化学变化的是( )
A、①②⑤ B、②③④ C、①⑤⑥ D、全都是
5、已知:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1。现将一定量的稀盐酸、浓硫酸、稀醋酸分别和1mol/L 1L的NaOH溶液恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2和△H3的大小关系为( )
A、△H1>△H2>△H3 B、△H3>△H2>△H1
C、△H3>△H1>△H2 D、△H2>△H1>△H3
6、在一定条件上,分别以KMnO4、KClO3、H2O2为原料制取氧气,当制得同温同压下相同体积的氧气时,三个反应中转移的电子数之比为( )
A、1:1:1 B、2:2:1 C、2:3:1 D、4:3:2
7、下列情况中,一定能说明金属M比N的金属性强的是( )
①将N置于Cu(NO3)2溶液中,N表面覆盖上紫红色物质;将M置于Cu(NO3)2溶液中,放出H2并产生蓝色沉淀。
②将M、N用导线连接直接插入稀硫酸中,M溶解,N上有H2产生。
③同价态的阳离子,M比N的氧化性强。
④电解含M离子和N离子的混合溶液,阴极首先析出M。
⑤碱性M(OH)x>N(OH)Y
A、①②③ B、①② C、③④ D、③④⑤
8、在反应aFeCl2+bKNO3+cHCl=dFeCl3+eKCl+fX+gH2O中,若b=1,d=3,X为不含铁的化合物,则x的分子式应为( )
A、N2 B、NO2 C、NO D、NH4Cl
9、用含FeS2 78%的硫铁矿制硫酸,若煅烧时损失6%的硫,由SO2制SO3的转化率为98%,则制取1t的硫酸,需这种硫铁矿的质量是( )
A、1t B、2.5t C、0.48t D、0.84t
10、甲、乙两个电解池均以Pt为电极,且互相串联,甲池盛有AgNO3溶液,乙池中盛有一定量的其盐溶液,通电一段时间后,测得甲池中电极质量增加2.16g,乙池中电极上析出0.24g金属,则乙池中溶质可能是( )
A、CuSO4 B、MgSO4 C、Al(NO3)3 D、Na2SO4
二、选择题(每题有1-2个正确答案)
11、KClO3可与浓盐酸反应产生Cl2:KClO3+6HCl=KCl+3Cl2↑+3H2O,若反应中使用的是K37ClO3和H35Cl,则所得Cl2的摩尔质量(单位是g/mol)是( )
A、70.7 B、71 C、72 D、73.3
12、下列关于酸性氧化物的叙述中正确的是( )
A、酸性氧化物不可能是金属氧化物 B、酸性氧化物不能与酸反应
C、酸性氧化物都可与强碱反应 D、酸酐都是酸性氧化物
13、下列各组离子在溶液中可以大量共存,且加入过量氨水最终不产生沉淀的是( )
A、K+、Ba2+、NO3-、HCO3- B、H+、Ag+、NO3-、K+
C、Na+、AlO2-、Cl-、OH- D、H+、Na+、I-、NO3-
14、有A、B两种化合物均由X、Y两种元素组成,已知A中含X44%,B中含X34.4%,若A的最简式为XY2,则B的最简式为( )
A、X2Y B、XY C、XY3 D、X3Y
15、下列离子方程式书写正确的是( )
A、AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
B、FeCl3溶液中通入H2S气体:2Fe3++S2-=2Fe2++S↓
C、澄清石灰水中加入少量小苏打溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
D、次氯酸钙溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
16、已知298K时,SO2(g)+![]() O2(g)=SO3(g);△H=-98.5kJ/mol。在相同温度和压强下,向密闭容器中通入1mol SO2和0.5 molO2,达到平衡时放出热量Q1;向另一个相同体积的密闭容器中通入2mol SO2和1mol O2,达到平衡时放出热量Q2,则下列关系式正确的是( )
O2(g)=SO3(g);△H=-98.5kJ/mol。在相同温度和压强下,向密闭容器中通入1mol SO2和0.5 molO2,达到平衡时放出热量Q1;向另一个相同体积的密闭容器中通入2mol SO2和1mol O2,达到平衡时放出热量Q2,则下列关系式正确的是( )
A、Q1=![]() B、Q1<
B、Q1<![]() C、Q1<Q2=197kJ D、Q1=Q2<197kJ
C、Q1<Q2=197kJ D、Q1=Q2<197kJ
17、用Pt电极电解NaCl和CuSO4的混合溶液,当电路中通过4mol电子时,阴、阳极都得到1.4mol气体,电解后溶液的体积为4L,则最后电解溶液的pH值接近于( )
A、1 B、2 C、13 D、14
18、1999年曾报道合成和分离了含高能量的正离子N5+的化合物N5ASF6,下列叙述中错误的是( )
A、N5+共有34个核外电子 B、N5+中氮-氮原子间以共用电子对结合
C、化合物N5ASF6中AS的化合价为+1 D、化合物N5ASF6中F的化合价为-1
19、三氟化溴跟水的化学反应是:3BrF3+5H2O=9HF+HBrO3+O2↑+Br2,在此反应中,氧化剂和还原剂的物质的量之比是( )
A、3:5 B、4:3 C、2:3 D、5:3
20、CuI是一种白色难溶于水的固体。以石墨作阴极,铜为阳极组成电解池,含有酚酞和淀粉KI的溶液作电解液。电解开始一段时间,阴极区溶液变红,阳极区仍为无色。电解相当长时间后,阳极区才呈深蓝色。则电解开始阶段的电极反应为( )
A、阳极:Cu-2e-=Cu2+ B、阳极:2Cu+2I—2e-=2CuI
阴极:Cu2++2e-=Cu 阴极:2H++2e-=H2↑
C、阳极:2I--2e -=I2 D、阳极:4OH—4e-=2H2O+O2↑
阴极:2H++2e-=H2↑ 阴极:4H++4e-=2H2↑
二、填空题:
21、配平下列离子方程式:
Fe(OH)3+ ClO-+ OH-—— FeO4n-+ Cl-+ H2O
(1)已知有3.21gFe(OH)3参加反应,若转移了5.4×1022个电子,则n= ,FeO4n-中铁的化合价为 。
(2)根据上述事实推测,FeO4n-能和下列 物质反应(填序号)
A、KMnO4 B、SO2 C、H2S D、O2
22、把10mL淀粉胶体和5mLKI 溶液的混合液体加入用半透膜制成的袋内,将此袋浸入蒸馏水中。2min后,用两支试管各取5mL烧杯中的液体,并做如下实验:
(1)向其中一支试管里滴加少量AgNO3溶液,其现象是 。
(2)向另一支试管里滴加少量碘水,其现象是 。
(3)由上述实验得出的结论是 。
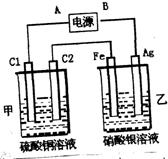
23、如图装置进行电解,在通电一段时间后,铁电极的质量增加。
(1)电源中A极是 极,B极是 极。
(2)乙杯中,两极发生的电极反应式: 、 。
(3)甲杯中发生反应的化学方程式 。
(4)在甲杯中,电解过程中 极(填C1或C2)附近溶液pH值发生明显变化,溶液pH值变 (填大或小)。
(5)C1、C2、Fe、Ag四个电极上析出或溶解物质的物质的量之比是 。
24、下图表示一些晶体中的某此结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
(1)其中代表金刚石的是(填编号字母,下同) ,其中每个碳原子与 个碳原子最接近且距离相等。金刚石属于 晶体。
(2)其中代表石墨的是 ,其中每个正六边形占有的碳原子数平均为 个。
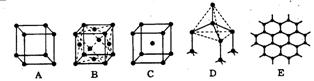
(3)其中表示NaCl的是 ,每个Na+周围与它最接近且距离相等的Na+有 个。
(4)代表CsCl的是 ,它属于 晶体,每个Cs+与 个Cl-紧邻。
(5)代表干冰的是 ,它属于 晶体,每个CO2分子与 个CO2分子紧邻。
(6)上述五种物质熔点由高到低的排列顺序为 。
25、某河道两旁有甲、乙两厂,它们排放的工业废水中共含K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。
甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是 。乙厂的废水中含有另外三种离子。如果加一定量 (选填:“活性炭”、“硫酸亚铁”、“铁粉”),可以回收其中的金属 (填写元素符号)。另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 (填写离子符号)转化为沉淀,经过滤后的废水主要含 ,可用来浇灌农田。
四、计算题:
26、将10.08g铁粉溶于过量的稀硫酸,所得溶液加入5.05g KNO3氧化溶液中的Fe2+,待反应完毕后,剩余的Fe2+尚需30mL 0.5mol/L 的溴水才能全部氧化。通过计算确定后两个反应的化学方程式。
27、某温度下,将一定质量密度为1.15g. cm-3的氯化钠溶液通电,设NaCl恰好完全电解且无其他反应发生,得到的溶液中氧元素的质量分数为80%,求:
(1)电解完全后,溶液中溶质与溶剂的物质的量之比。
(2)原NaCl溶液的物质的量浓度为多少?
【练习答案】
一、
1、A 2、D 3、C 4、C 5、C
6、B 7、B 8、C 9、D 10、A
二、
11、A 12、C 13、BC 14、C 15、AC
16、B 17、C 18、C 19、C 20、B
三、
21、2 5-n 2n 2 5-n 3+n
(1)2 +6 (2)BC
22、(1)出现黄色沉淀 (2)无明显现象 (3)I-能透过半透膜,淀粉胶体不能透过半透膜。
23、(1)负 正 (2)阳极:Ag-e-=Ag+,阴极:Ag++e-=Ag
(3)2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4 (4)C2 小 (5)2:1:4:4
2Cu+O2↑+2H2SO4 (4)C2 小 (5)2:1:4:4
24、(1)D 4 原子 (2)E 2
(3)A 12 (4)C 离子 8
(5)B 分子 12 (6)石墨>金刚石>NaCl>CsCl>干冰
25、OH-、Cl-、K+ 铁粉 Ag Ag+、Fe3+、Cl-、OH- KNO3
四、
26、6FeSO4+2KNO3+4H2SO4=3Fe2(SO4)3+K2SO4+2NO↑+4H2O
6FeSO4+3Br2=2Fe2(SO4)3+2FeBr3
27、(1)1:10 (2)4.48mol/L