高三化学期末测试
化学试卷
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分150分,考试用时120分钟,闭卷考试。
第Ⅰ卷(选择题74分)
可能用到的相对原子质量:H1 C12 N14 O16 S32
Cl35.5 Ca40 K39 Fe56 Cu64
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.我国“神舟“四号航天飞船成功发射升空,表明我国的载人航天技术已经有了突破性的
进展。在运送飞船的某些火箭推进器中盛有液态肼(N2H4)和液态双氧水,它们充分混
合反应后的产物之一是 ( )
A.氧气 B.氮气 C.氨气 D.氢气
2.下列物质的溶液,不易被氧化、不易被分解且能存放在具有磨口玻璃塞的无色试剂瓶中的是( )
A.烧碱 B.硝酸 C.醋酸 D.苯酚
3.一氯氨(NH2Cl)中氨基离子带负电荷,预计它跟水反应的最初生成物是 ( )
A.NH3和HClO B.NH2OH和HCl
C.NH3·H2O和HCl D.NH3和HClO3
4.大气污染物氟里昂—12的分子式是CF2Cl2,它是一种卤代烃,关于它的说法中正确的是( )
A.它有两种同分异构体 B.它是极性分子
C.它的空间构型为正四面体 D.它不属于有机物
5.下列关于实验室制取气体所用试剂的组合不合理的是 ( )
A.制Cl2: MnO2、HCl(浓) B.制H2:H2SO4(稀)、Zn
C.制O2: MnO2、H2O2 D.制CO2:H2SO4(稀)、CaCO3
6.近年来用红外激光技术研究液氢时,发现分子间作用力也可引起粒子间的反应。在液氢
中有氢分子和质子形成的H3+离子,其构型是等边三角形;H3+还可进一步形成Hn+。下列
判断正确的是 ( )
A.H3+可在液氢中开成H5+、H7+、H9+
B.每个H3+粒子中含有2个质子
C.H3+可在液氢中形成H4+、H5+、H6+
D.H3+可广泛存在于固态、液态和气态氢中
7.下列说法中不正确的是 ( )
①质子数相同的粒子一定属于同种元素;
②同位素的性质几乎完全相同;
③质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;
④电子数相同的粒子不一定是同一种元素;
⑤一种元素只能有一种质量数;
⑥某种元素的相对原子质量取整数,就是其质量数。
A.①②④⑤ B.③④⑤⑥ C.②③⑤⑥ D.①②⑤⑥
![]()
![]() 8.根据“绿色化学”的思想,某化学家设计了下列化学反应步骤: ( )
8.根据“绿色化学”的思想,某化学家设计了下列化学反应步骤: ( )
![]()
![]() ①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2↑
①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2↑
③HgBr2+CaO HgO+CaBr2 ④2HgO 2Hg+O2↑
该方案的目的是为了制备
A.HBr B.CaO C.H2 D.Hg
二、选择题(本题有10小题,每小题5分,共50分,且每小题有一个或两个正确选项;漏
选得2分,多选、错选不得分)
9.以NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1L0.1mol·L-1的醋酸溶液中含离子和分子总数是0.1NA
B.22.4L氖气中所含原子数为NA
C.1.6gNH2-离子中所含电子数为NA
D.2gD2O所含中子数为NA
10.关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛其化学机
理为: ( )
 ①HUr+H2O Ur-+H3O+
①HUr+H2O Ur-+H3O+
②Ur-(aq)+Na+(aq) NaUr(s)
下列对反应②叙述中正确的是
A.反应的△H>0 B.反应的△H<0
C.升高温度平衡向正反应方向移动 D.降低温度平衡向正反应方向移动
11.实验室将NaClO3和Na2SO3按分子个数比为2:1倒入烧瓶中,同时滴入适量硫酸,并
用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和 Na2SO3恰好完全反应,则X为 ( )
A.Cl2 B.Cl2O C.ClO2 D.Cl2O3
12.在下列条件下,两种气体的分子数一定相等的是 ( )
A.同质量不同密度的C2H4和CO B.同温度同体积的C2H6和NO
C.同温度同压强的CO和N2 D.同体积、同压强的N2和C2H4
13.生物体中细胞膜内的葡萄糖与细胞膜外的富氧液体及细胞膜构成微型的生物原电池,下
列有关电极反应及产物的判断正确的是 ( )
A.负极反应可以是O2+4e-+2H2O→4OH-
B.负极反应的产物主要是C6H12O6补氧化生成的CO32-、HCO3-、H2O
C.正极反应可能是C6H12O6—24e-+24OH-→6CO2+18H2O
D.正极反应的产物主要是葡萄糖生成的CO2、CO32-和H2O
14.美国Lawtcce Lirermre国家实验室(LLNL)的V·Lota·C·S·Yoo和H·Cynn成功
地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2原子晶体的说
法正确的是 ( )
A.CO2的原子晶体和分子晶体互为同素异形体
B.在一定条件下,CO2原子晶体转化为分子晶体是物理变化
C.CO2的原子晶体和CO2分子晶体具有相同的物理性质
D.在CO2的原子晶体中,每一个碳原子周围结合4个氧原子,每一个氧原子跟两个碳原子相结合
15.通常状况下,下列各选项中的两个量,前者一定大于后者的是 ( )
A.物质的量浓度相等的次氯酸钠溶液和醋酸钠溶液的pH
B.25℃的纯水和100℃的纯水中的c(H+)
C.物质的量浓度相等的硫酸铵溶液和氯化铵溶液中c(NH4+)
D.读取量筒中一定体积的液体时,仰视的读数和俯视的读数
|
A.水杨酸 和NaHCO3反应
B.丙烯和HBr发生加成反应
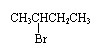
C. NaOH的醇溶液共热
D.丙醇、异丙醇和浓硫酸共热发生分子内脱水反应
17.有下列两种说法:
①一种碱溶液与一种盐溶液混合反应后,产物之一是强碱性物质;
②两种酸溶液伸混合反应后,溶液的酸性减弱。
其中确有具体例证存在的是 ( )
A.只有① B.①和② C.只有② D.都不存在
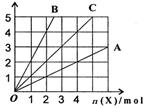
18.如图所示,横坐标表示完全燃烧时消耗可燃气体X(X=A、B、C)的物质的量n(X),纵
|
C中n(A):n(B)为 ( )
A.2:1 B.1:2
C.1:1 D.任意比
第Ⅱ卷(非选择题 共76分)
三、(本题包括2小题,共20分)
在实验室利用胆矾晶体和烧碱溶液,经下列步骤制备氧化铜固体:
①溶解胆矾; ②滴加烧碱溶液; ③过滤; ④灼烧滤渣。试填空:
(1)在实验中多次用到玻璃棒,其作用有三个,分别是 ;
; 。
(2)氢氧化铜微热即分解,其化学反应方程式是 。
(3)乙同学改进了上述实验步骤,即把“先过滤后灼烧”改为“先加热浑浊液后过滤”。因为甲的后两步操作顺序的缺点是
。
|
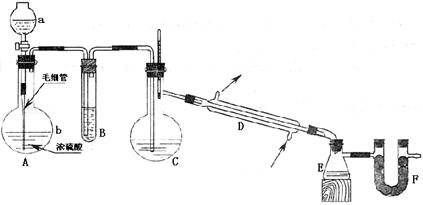
所用到的试剂有:①密度为1.19g·cm-3的浓盐酸; ②密度为1.84g·cm-3质量分数为98.3%的浓硫酸(98.3%的浓硫酸沸点是338℃); ③发烟硫酸; ④无水氯化钙 ⑤水;⑥碱石灰。试填空:
(1)对应仪器中应盛入的试剂或药品(填序号):
A中的a为 ;B中为 ,C 中为 。
(2)A中的分液漏斗下端接有的毛细管的作用是 ;将毛细管插入液面并接近烧瓶底部这是为了 ;若不用毛细管直接用分液漏斗注入 a中液体,可能发生的现象是 。
(3)写出实验室制备氯磺酸的化学方程式 ;反应到一定程度时需用酒精灯在C装置下加热的作用是: 。
(4)F装置中加入的试剂是 (填序号,限在本题给定的试剂中选择),其作用是
。
四、(本题包括2小题,共14分)
21.(6分)将铝制品与另一种材料作电极,以某种溶液作电解液进行电解,通电后在铝制品与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部位存在着小孔,电流从小孔通过并产生热量使Al(OH)3分解,从而在铝制品表面形成一层较厚的氧化膜。某校研究性学习小组根据上述原理,以铝制品和铁棒为电极,一定浓度的NaHCO3溶液为电解液进行实验。
(1)铝制品表面形成氢氧化铝薄膜的电极反应式为 。
(2)电解过程中,必须使电解液的pH保持相对稳定(不能太大,也不能太小)的原因是
。
(3)使用NaHCO3溶液为电解液,会减缓阴极区溶液pH值的增大,能说明这一原理的离子方程式为 。
|
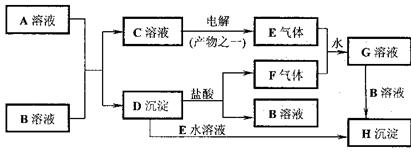
试回答:
(1)写出化学式:A ;B 。
(2)写出下列反应的离子方程式:
①C→E: ;
②D→H: ;
③E+F+H2O→G: 。
五、(本题包括2小题,共22分)
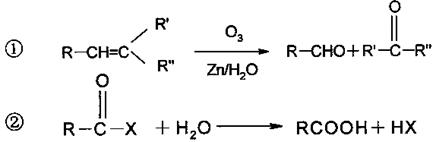
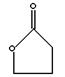
23.(12分)已知某些有机物能发生如下反应:
|
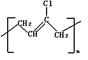
某高分子化合物(C4H5Cl)n能发生如下转化:
|
(1)写出A、D的结构简式:A ;D 。
(2)写出B转化为C的化学方程式:
。
(3)写出C转化为E的化学方程式:
。
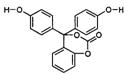
|
![]() RCOOR’+2H2 RCH2OH+HO-R’
RCOOR’+2H2 RCH2OH+HO-R’
试填空:
(1)该有机物分子中的三个苯环 共平面(选填“能”或“不能”)。
(2)该有机物的的化学式为 。
(3)该有机物与足量氢氧化钠溶液充分反应后的产物中,相对分子质量较小钠盐的化学式为 。
(4)1mol该有机物在铜铬氧化物催化下能与 mol氢气充分反应。
六、(本题包括2小题,共20分)
25.(12分)在100℃时,将0.100mol的四氧化二氮气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间/S 浓度/mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4)/ mol·L-1 | 0.100 | c1 | 0.050 | c3 | a | B |
| C(NO2)/ mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应的化学方程式为 ;
达到平衡时四氧化二氮的转化率为 %;
表中c2 c3 a b(选填“>”、“<”、“=”)。
(2)20s时四氧化二氮的浓度c1= mol·L-1,在0s~20s内四氧化二氮的平均反应速率为 mol·L-1;
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是 mol·L-1。
26.(8分)某校兴趣小组同学一定浓度的三氯化铁溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板,有关反应为:2FeCl3+Cu=2FeCl2+CuCl2。现将一块敷有铜箔的绝缘板浸入200mL某FeCl3溶液A中,一段时间后,把该线路板取出;向所得溶液B中加入适量铁粉充分反应后,将剩余固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.mL;再向取出液中滴入0.0600mol·L-1AgNO3溶液100mL,此时,溶液中氯离子恰好完全沉淀。
试计算:
(1)溶液A中FeCl3的物质的量浓度:
(2)假若铁粉不再溶液,向溶液B中加入的铁粉质量至少应大于多少克?
参考答案
第Ⅰ卷(选择题 共74分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | B | C | A | B | D | A | D | C | ||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | CD | BD | C | A | B | D | AC | BC | B | A |
第Ⅱ卷(非选择题 共76分)
三、(共20分)
19.(8分)(1)搅拌、引流、转移 (每个操作1分,共3分)
(2)Cu(OH)2 微热 CuO+H2O(2分)
(3)过滤所耗时间较长(3分)
20.(12分)(1)浓盐酸,浓硫酸,发烟硫酸;(每格1分,共3分)
(2)控制浓盐酸流量;使密度较小的盐酸进入浓硫酸中;飞溅;(每格1分,共3分)
![]() (3)SO3+HCL HSO3CL(1分);蒸馏出沸点比浓硫酸低的氯磺酸。(1分)
(3)SO3+HCL HSO3CL(1分);蒸馏出沸点比浓硫酸低的氯磺酸。(1分)
(4)⑥(2分);吸收HCL气体和吸收空气中水分作用(2分)
![]() 四、(共14分) 21.(6分)(1)AL-3e-+3HCO3-
AL(OH)3↓+3CO2↑(2分)
四、(共14分) 21.(6分)(1)AL-3e-+3HCO3-
AL(OH)3↓+3CO2↑(2分)
(2)AL(OH)3和AL2O3都是两性物质,当电解液呈酸性或强碱性时,刚形成的AL2O3薄膜会被电解液溶解。(2分)
(3)HCO3-+OH- CO32-+H2O(2分)
22.(8分)(1)A:Na2SO3 B:BaCL2(每空各1分,共2分)
(2)①:2Cl-+H2O 电解 2OH-+H2↑+Cl2↑(2分)
②:BaSO3+Cl2+H2O BaSO4↓+2H++2Cl-(2分)
|
|
23.(12分)(1)A ; D
![]() (2)写出B转化为C的化学方程式:HOOCCH2CH2CHO+H2
HOOCCH2CH2CH2OH
(2)写出B转化为C的化学方程式:HOOCCH2CH2CHO+H2
HOOCCH2CH2CH2OH
|
(3)写出C转化为E的化学方程式: (每空3分,共12分)
24.(10分)(1)不能 (2分) (2)C20H14O5(2分) (3)Na2CO3 (3分) (4)3 (3分)
六、(共20分)
![]() 25.(12分)①N2O4
2NO2 (不写可逆号、不配平均不得分)60%
> = =(每空1分,共7分)
25.(12分)①N2O4
2NO2 (不写可逆号、不配平均不得分)60%
> = =(每空1分,共7分)
② 0.030 (1分)0.0015(2分) ③0.200(2分)
26.(共8分)(1)因为:Ag++Cl-=AgCl↓(1分) 所以:n(Fe3+)=![]() (1分)
(1分)
![]() (1分)
(1分)
则:![]()
(1分) 答:溶液A中FeCl3的物质的量浓度是1.00mol·L-1。
(2)因为:![]() Ca2++Fe=Fe2++Cu; 2Fe3++Fe=3Fe2+.
Ca2++Fe=Fe2++Cu; 2Fe3++Fe=3Fe2+.
所以消耗铁粉的量可以由n(Fe3+)直接计算:
![]() (三个方程式每个1分,共3分,或直接得出文字说明也是3分。)
(三个方程式每个1分,共3分,或直接得出文字说明也是3分。)
m(Fe)=56g·mol-1×0.100mol=5.60g(1分)
答:向溶液B中加入的铁粉质量至少应大于5.60g。