高三化学期末抽样测试试卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32
Cl-35.5
一、选择题(本题包括18小题,每小题4分,共72分。每小题只有一个选项符合题意。)
1.168O、188O、O2-、O2、O3是
A.氧元素的五种不同微粒 B.五种氧元素
C.氧的五种同素异形体 D.氧的五种同位素
2.下列各分子中,所有原子都满足最外层电子为8电子结构的是
A.CCl4 B.BF3 C.H2O D.PCl5
3.下列说法正确的是
A.离子晶体中可能含有共价键,但一定含有金属元素
B.分子晶体中有一定含有共价键
C.离子晶体中一定不存在非极性键
D.石英与晶体硅都是原子晶体
4.将KNO3不饱和溶液Wg,恒温蒸发直到有晶体析出。在这个变化过程中,可用下图表示溶液的溶质质量分数(v)随蒸发时间(t)而变化的是
5.反应2A(气)![]() 2B(气)+C(气)-Q达平衡时,要使
2B(气)+C(气)-Q达平衡时,要使![]() 降低、[A]增大,应采取的措施是
降低、[A]增大,应采取的措施是
A.加压 B.减压 C.减小[C] D.降温
6.我国已经禁止使用含PPA的抗感冒药,PPA是苯丙醇铵的英文缩写。
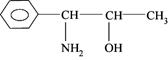 它的结构简式为:
它的结构简式为:
下列关于它的叙述错误的是
A.一定条件下发生消去反应
B.有弱酸性,可与强碱反应生成盐
C.一定条件下跟Br2发生苯环上的取代
D.有弱碱性,可与强酸反应生成盐
7.下列叙述正确的是
A.同周期元素中,ⅦA族元素的原子半径最大
B.现已发现的零族元素的单质在常温常压下都是气体
C.ⅥA族元素的原子,其半径越大,越容易得到电子
D.所有的主族元素的简单离子的化合价与其族序数相等
8.将20mL 0.4 mol·L-1硝酸铵溶液与10mL 0.1mol·L-1氢氧化钡溶液混合,则混合后溶液中各离子浓度的大小顺序是
A.![]()
B.![]()
C.![]()
D.![]()
9.溶质质量分数为a1的某物质的溶液m1 g与溶质质量分数为a2的该物质的溶液m2 g混合后,蒸发掉p g水,得到的溶液每毫升质量为q g,物质的量浓度为c mol·L-1。则溶质的分子量(相对分子质量)为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
10.向0.1 mol·L-1的CH3COOH溶液中加入CH3COONa晶体或加水稀释时,都会引起
A.溶液的pH增加 B.CH3COOH电离程度增大
C.溶液导电能力减弱 D.溶液中[OH-]减小
11.1 mol某烃充分燃烧,共消耗标准状况下氧气179.2L。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是
A.(CH3)3CCH2CH3 B.CH3CH2CH2CH2CH3
![]() C.CH3CH2CH(CH3)2 D.
C.CH3CH2CH(CH3)2 D.
12.25℃时,向1 mL pH=a的盐酸中滴加10 mL pH=b的NaOH溶液,当溶液中n(Cl)=n(Na+)时,则a+b的值为
A.13 B.14 C.15 D.不能确定
13.下列离子方程式书写正确的是
A.碳酸钙溶于醋酸中 CaCO3+2H+=Ca2++H2O+CO2↑
B.金属钠投入水中 Na+H2O=Na++OH-+H2↑
C.氢氧化亚铁溶于稀硝酸 Fe(OH)2+2H+=Fe2+2H2O
D.氯化铁溶液中加过量氨水 3NH3·H2O+Fe3+=3NH4++Fe(OH)3↓
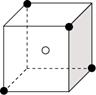 14.某离子晶体结构如图所示,X(●表示)位于立方体的顶点,Y(○表示)位于立方体的中心。该晶体的化学式应为
14.某离子晶体结构如图所示,X(●表示)位于立方体的顶点,Y(○表示)位于立方体的中心。该晶体的化学式应为
A.XY2
B.X2Y
C.X4Y
D.XY3
15.在由水电离产生的[H+]=1×10-14mol·L-1的某无色溶液中一定能大量共存的是
A.Fe2+、K+、SO42-、NO3- B.Mg2+、NH4+、SO42-、Cl-
C.Na+、K+、SO42-、NO3- D.Ba2+、Na+、SO42-、MnO4-
16.可逆反应:N2+3H2![]() 2NH3的正、逆反应速率可用各反应物或生成物的浓度变化来表示。下列各关系中能说明反应已经达到化学平衡的是
2NH3的正、逆反应速率可用各反应物或生成物的浓度变化来表示。下列各关系中能说明反应已经达到化学平衡的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
17.某炼金厂的废水因连降暴雨而溢出,导致河水严重污染。炼金废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸。下列说法不正确的是
A.CN-可以和稀硫酸反应生成HCN
B.CN-可被Cl2氧化成(CN)2
C.在水溶液中(CN)2可被F-还原
D.HCN的电子式为
![]()
18.下列说法正确的是(设NA为阿伏加德罗常数)
A.常温常压下,活泼金属从盐酸中置换出1 mol H2,转移电子数为NA
B.标准状况时,以任意比例混合的CH4和C3H8 22.4L含分子数为NA
C.标准状况时,1L辛烷完全燃烧得到气态产物的分子数为![]() NA
NA
D.常温常压下,1.8g重水(D2O)含电子数为NA
二、(本题包括2小题,共计24分。)
19.(12分)A、B、C、D均为短周期元素,B、A可形成两种液态化合物,其原子个数比分别为1∶1和2∶1,且分子中电子总数分别为18和10。B与D能形成一种极易溶于水的碱性气体X,B与C能形成极易溶于水的酸性气体Y,Y分子中的电子数为18。A、B、D能形成一种离子化合物,其水溶液呈弱酸性。请写出:
(1)C的元素符号_____,X跟Y反应的化学方程式________________________。
(2)用离子方程式解释A、B、D形成的化合物水溶液呈弱酸性的原因是________________。
(3)铋(Bi)跟C元素能形成化合物(BiC3),其水解生成难溶于水的(BiOC)。
①
BiC3水解反应的化学方程式为__________________________。
②把适量的BiC3溶于含有少量Y的水中,能得到澄清溶液,试分析可能的原因________________________________________。
③医药上把BiOC叫做“次某酸铋”,分析这种叫法的不合理之处。
__________________________________________________________。
20(12分)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
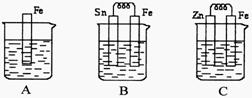
(1)A中反应的离子方程式为________________________________。
(2)B中Sn极的电极反应式为_____________________,Sn极附近溶液的pH(填“增大”、“减小”或“不变”)_______________。
(3)C中被腐蚀的金属是___________,总反应式为________________________________。
比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是___________________。
三、(本题包括2小题,共计19分。)
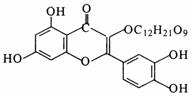 21.(6分)天然维生素P存在于槐树花蕾中,它是一种营养增补剂,其结构如图所示:
21.(6分)天然维生素P存在于槐树花蕾中,它是一种营养增补剂,其结构如图所示:
(1)它的分子式________________。
(2)它一定具有的性质(填序号)_________。
A.能跟NaOH溶液反应 B.能发生银镜反应
C.能发生水解反应 D.能发生加成反应
E.能发生取代反应 F.能跟FeCl3溶液反应
(3)该分子中一定在同一平面上的碳原子有________个。
22.(13分)根据图示填空:
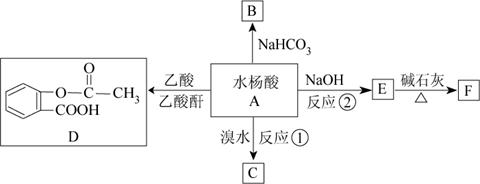
(1)化合物A的结构简式是__________________________________。
(2)反应①的反应类型是_________________________________。
(3)反应②的化学方程式是______________________________。
(4)与D具有相同官能团的D的同分异结构(苯环上只有两个取代基)有_______种,请写出其中任意三种同分异结构体的结构简式:_______________________________________。
四、(本题包括2小题,共计16分。)
23.(4分)请你选用下列试剂 ①紫色石蕊试剂、②酚酞试液、③甲基橙试液、④蒸馏水、⑤BaCl2溶液、⑥pH试纸、⑦0.1 mol·L-1 Na2S2O3溶液,设计两种不同的试验方案,区别物质的量浓度分别为0.05 mol·L-1和0.005 mol·L-1的两种稀硫酸,简述操作过程。
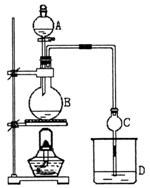 24.(12分)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
24.(12分)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知 ①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是_____________________________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式______________________。
(2)球形干燥管C的作用是____________________________________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)____________________;反应结束后D中的现象是____________________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出_______________;再加入(此空从下列选项中选择)__________,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
五、(本题包括2小题,共计19分。)
25.(5分)将镁带在空气中燃烧的产物全部溶解在50mL 1.8 mol·L-1的盐酸中,再以20 mL 0.9mol·L-1的NaOH溶液中和,至溶液pH=7。然后在此溶液中加过量的热碱,使溶液中的氨全部释放。经测量氨为0.006mol。计算:镁带的物质的量。
26.(14分)现有A、B两种链状饱和一元醇的混合物0.3 mol,其质量为13.8g。已知A和B碳原子数均不大于4,且A<B。
(1)混合物中A可能的分子式___________;B可能的分子式_____________。
(2)若n(A) : n(B)=1:1时,
A的名称________________;B的名称_______________。
(3)若n(A) : n(B)≠1:1
时,
A的结构简式为_____________________________________;
B的结构简式为_____________________________________。
则n(A) : n(B)=__________。
 |
『答案』
一、单项选择(本题包括18小题,每小题4分,共计72分。)
1、A 2、A 3、D 4、C 5、D 6、B 7、B 8、D 9、C 10、A
11、B 12、A 13、D 14、A 15、C 16、C 17、C 18、B
二、(本题包括2小题,每空2分,共计24分。)
19.(12分)(1)Cl NH3+HCl=NH4Cl
(2)NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
(3)①BiCl3+H2O=BiOCl↓+2HCl(或BiCl3+H2O![]() BiOCl+2HCl)
BiOCl+2HCl)
②盐酸能抑制BiCl3的水解
③BiOCl中的Cl的化合价为-1价
20.(12分)(1)Fe+2H+=Fe2++H2↑
(2)2H++2e=H2↑ 增大
(3)Zn Zn+H2SO4=ZnSO4+H2↑ B、A、C
三、(本题包括2小题,共计19分。)
21.(5分)(1)C27H30O16(2分)
(2)A、D、E、F(3分,错一个扣1分,但不得负分)
(3)此问过难,不要求学生作答
22.(14分)
![]() (1)(2分) (2)取代反应(1分)
(1)(2分) (2)取代反应(1分)
(3) (2分)
(4)11(3分)
![]() 等。
等。
(6分,每个2分)
四、(本题包括2小题,共16分。)
23.(4分)
方法① 用洁净的玻璃棒蘸取溶液点在pH试纸上,把变色的pH试纸与标准比色卡比较,pH=1的为0.05mol·L-1得H2SO4。(2分)
方法② 各取等体积0.1mol·L-1 Na2S2O3溶液,分别加入等体积的不同物质的量浓度的硫酸,较快出现浑浊的一瓶是0.05mol·L-1硫酸。(2分)
24.(12分)
(1)制乙酸、催化剂、吸水剂(或干燥剂)(2分)
CH3COOH+C2H518OH![]() CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
(2分,18O可标在乙醇中或乙酸中,但不标18O或标错,则扣2分)
(2)防止倒吸、冷凝蒸气(2分)CO32-+H2O![]() HCO3-+OH-(2分)
HCO3-+OH-(2分)
溶液分层,上层无色油状液体,下层溶液颜色变浅(2分)
(3)乙醇(1分) C(1分)
五、(本题包括2小题,共19分。凡其他合理答案均酌情给分。)
25.(5分)加入热碱前,体系是含Mg2+、Na+、NH4+、Cl-的电解质溶液。
n(Cl-)=n(HCl)=1.8 mol·L-1×0.05L=0.09mol————————————————(1分)
n(Na+)=n(NaOH)=0.9 mol·L-1×0.02L=0.018mol———————————————(1分)
n(NH4+)=n(NH3)=0.006 mol————————————————————————(1分)
依电荷守恒得:2n(Mg2+)+n(Na+)+n(NH4+)=n(Cl-)——————————————(1分)
代上述数据得:n(Mg)=n(Mg2+)=0.033mol—————————————————(1分)
26.(14分)(1)CH4O(2分) C3H8O或C4H10O(2分)
(2)甲醇(2分) 1—丙醇、2—丙醇(2分)
(3)CH3OH (2分)
CH3CH2CH2CH2OH、CH3CH2CH(OH)CH3、(CH3)2CHCH2OH、(CH3)3COH(2分)
2∶1(2分)