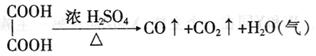ksk
高三化学期末综合测试
化 学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分150分。考试时间120分钟。
第Ⅰ卷(选择题 共74分)
可能用到的原子量:
H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Cl 35.5 Fe 56 Cu 64
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个个选项符合题意。)
1.室温时下列电解质溶液的浓度越大,密度就越小的是 ( )
A.HCl B.HNO3 C.H2SO4 D.NH3·H2O
2.以石墨作电极,电解CuSO4溶液,若阳极上析出氧气8g,则此时在阴极上析出铜的质量
是 ( )
A.8g B.16g C.32g D.64g
3.向NaAlO2溶液中持续通入一种气体,开始时产生沉淀,随后沉淀又逐渐溶解,该气体是( )
A.NO2 B.CO2 C.NH3 D.CO
4.某元素的最高价含酸的阴离子符号是RO3-,则该元素的气态氢化物的化学式是 ( )
A.HR B.H2R C.RH3 D.不能确定
5.已知自然界中镓有两种质量数分别为69和71的同位素,而镓的平均相对原子质量为69.72,
这两种同位素的原子个数比应为 ( )
|
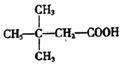
6.与 互为同分异构体的芳香族化合物最多有 ( )
A.6种 B.5种 C.4种 D.3种
7.已知0.1mo1·L-1的乙酸溶液的pH大于1,取等体积的乙二酸溶液与氢氧化钠溶液混合,
混合的pH等于7,则乙酸溶液与氢氧化钠溶液的物质的量浓度的比值是 ( )
A.大于![]() 、小于1 B.大于1、小于2
、小于1 B.大于1、小于2
C.等于![]() D.小于
D.小于![]()
8.甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时,放出222.5kJ热量,
则下列方程式中正确的是 ( )
A.CH4(气)+2O2(气)====CO2(气)+2H2O(气)+890kJ
B.CH4(气)+2O2(气)====CO2(气)+2H2O(液)+890kJ
C.CH4(气)+2O2(气)====CO2(气)+2H2O(液)-890kJ
D.CH4(气)+2O2(气)====CO2(气)+2H2O(气)-890kJ
二、选择题(本题包括10小题,每小题5分,共50分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都不正确的给5分,但只要选错一个,该小题就为0分。)
9.下列说法中,正确的是 ( )
A.周期表中的主族都有非金属元素
B. 周期表中的非有金属元素
C.周期表中的主族都有金属元素都位于短周期
D.周期表中的非金属元素都位于主族
10.在pH=13的溶液中能大量共存的离子组是 ( )
A.Na+、NH4+、Cl-、SO42- B.K+、Na+、AlO-2、Cl-
C.Mg2+、、K+、NO3-、Cl- D.K+、Na+、ClO-、SO32-
11.有机物A和B只由C、H、O中二种或三种元素组成;等物质的量的A和B完全燃烧时,消耗相等物质的量的氧气,则A和B的相对分子质量的差值(其中n为正整数)不可能为 ( )
A.0 B.14n C.18n D.44n
12.关于晶本的下列说法中,正确的是 ( )
A.在晶体中只要有阳离子就一定有阴离子
B.离子晶体都是离子化合物
C.分子晶体都是共价化合物
D.原子晶体都是固态单质
13.微型银锌电池是电子表和电子计算器的常用电源,其电极分别是Ag2O和Zn,电解质溶液是氢氧化钾溶液,电极反应式分别是 ( )
Zn+2OH--2e====ZnO+H2O Ag2O+H2O+2e====2Ag+2OH-
由此判断,下列说法中错误的是
A.锌是负极,氧化银是正极
B.在外电路中电流由氧化银流向锌极
C.原电池工作过程中,电解质溶液的pH减小
D.原电池反应的总化学方程式是Ag2O+Zn====2Ag+ZnO
14.下列离子方程式书写正确的是 ( )
A.少量固体Mg(OH)2溶于饱和NH4Cl溶液中
2NH4++Mg(OH)2===2NH3·H2O+Mg2+
B.氯化铝溶液中加入过量氨水
Al3++4NH3·H2O===AlO2-+4NH4++2H2O
C.烧碱溶液中通入过量二氧化硫
2OH-+SO2===SO32+H2O
D.100mL0.1mol·L-1的NaCO3溶液中加入0.01molCH3COOH
CO32-+CH3COOH===HCO3-+CH3COO-
15.在加热条件下,木炭与浓H2SO4反应,产生的气体所具有的性质是 ( )
A.能使BaCl2溶液变浑浊
B.能使酸性高锰酸钾溶液褪色
C.能使品红试液褪色
D.能使灼热的氧化铜变为亮红色
16.用足量的CO还原48.0g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60.0g沉淀,则该氧化物是 ( )
A.FeO B.Fe2O3 C.CuO D.Cu2O
![]() 17.两个容积相同的密闭容器A和B中充入SO2和O2,A各为1g,B各为2g,在同温下反应2SO2+O2 2SO3(气)达到平衡。下列说 法中,正确的是 ( )
17.两个容积相同的密闭容器A和B中充入SO2和O2,A各为1g,B各为2g,在同温下反应2SO2+O2 2SO3(气)达到平衡。下列说 法中,正确的是 ( )
A.平衡时,SO3、SO2、O2在A中的质量分数与在B中的质量分数相等
B.平衡时,SO3、SO2、O2在A中的生成速率与在B中的生成速率相等
C.平衡时,B中气体密度是A中气体密度的2倍
D.平衡时,B中气体压强是A中气体压强的2倍
18.在由Fe、FeO和Fe2O3组成的混合物加入100mL1.00mol·L-1的硫酸,恰好使混合物完全溶解,并放出0.448L气体(标准状况),此时溶液中无Fe3+,则下列判断正确的是( )
A.反应后所得溶液中的Fe2+与SO42-的物质的量之比为1:1
B.Fe、FeO、Fe2O3消耗硫酸的物质的量之比为1:1:2
C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
第Ⅱ卷(非选择题 共76分)
三、本题共2小题,20分
19.(8分)工业制纯碱时,第一步是通过饱和食盐水、氨和CO2反应,获得NaHCO3结晶,它的反应原理可以用下面的方程式表示:
NH3+CO2+H2O===NH4HCO3
NH4HCO3+NaCl(饱和)===NaHCO3+NH4Cl
这两个反应是在一一个反应器中完成的,其总结果是放热反应。
|
可选用的实验用品有:①6mol·L-1的盐酸、 ②6mol·L-1的硫酸、③浓氨水
④10%的氢氧化钠溶液、 ⑤澄清石灰水、⑥石灰石 、⑦食盐、⑧蒸馏水 ⑨冰水槽 ⑩其它常用仪器。
请回答下列问题:
(1)写出获得NaHCO3结晶的总反应方程式: 。
(2)A瓶上的分液漏斗内所装的试剂是 (填编号),B瓶内所装的试剂
是 (填编号),C瓶内所装的试剂是 (填编号),A、B、C瓶
中 瓶要放在冰水槽中。
|
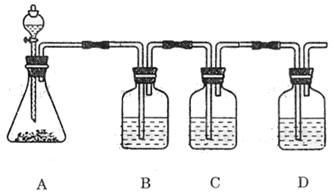
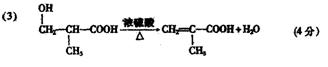
20.(12分)草酸 在浓H2SO4催化下加热反应的方程式为:
|
现用图1所示实验装置来检验此反应的所有气体产物,用图2所示实验装置来分离CO和CO2并干燥。图2中a、b分别是玻璃导管和分液漏斗的活塞。
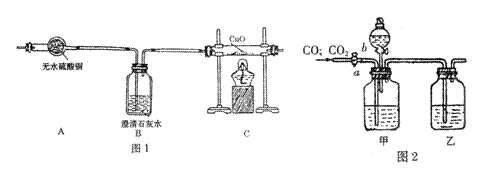
请回答下列问题:
(1)若图1装置中A、B、C三部分仪器的连接顺序改为A、C、B,则可检验出的物质
是 ,不能检验出的物质是 。
(2)图2装置中,分液漏斗所盛的溶液是 ,乙瓶所盛的溶液是 。
(3)简述用图2装置,从开始让混合气体通过甲、乙瓶到收集CO的操作过程:
。
四、本题共2小题,21分
21.(10分)有人曾建议用AG表示溶液的酸度(acidity grade),AG的定义为
AG=lg([H+]/[OH-])
请回答下列问题:
(1)在25℃时,若溶液呈中性,则AG= 。
(2)在25℃时,若溶液的pH=12,则AG= 。
(3)在25℃时,溶液的pH与AG的换算公式为AG= (要化简)。
(4)在25℃时,将AG=-12的NaOH溶液aL与AG=12的H2SO4溶液bL混合,若所
得混合液的AG=10,则a:b= 。
22.(11分)已知:
①A、B、C、D四种物质均含元素X,B和D还含有元素Y和Z,C还含有元素Z和W,A还含有元素Y。元素W、Z、Y、X的原子序数依次递增。W和Y同在一个主族,X和Z同在另一主族。
②X在C中呈现它的最高化合价,在A中呈现它的最低化合价。
③A、B、C三种物质在溶液中以物质的量之比2:1:3反应可得到物质的量之比为1:1:1的甲、乙、丙三种物质,甲就是X的单质。
④C和D二种物质在溶液中反应,所得到的生成物中有一种是组成仅为X和Z的化合物。
请回答下列问题:
(1)元素X是 ,Z是 。
(2)写出③ 的反应的化学方程式: 。
(3)写出④中反应的离子方程式: 。
五、本题共2小题,16分
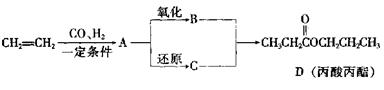
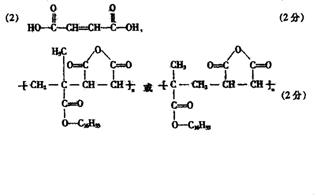
23.(6分)丙酸丙酯是一种香料,可以用下面的设计方案合成。
|
(1)写出A、B、C的结构简式
A: ,B: ,C: 。
(2)D有很多同分异构体,含有羧基的一共有 (填数字)种,在这几种
同分异构体中,烃基上一氯取代物有2种的是(用结构简式表示) 。
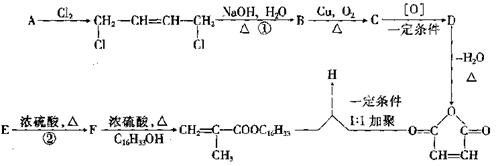
24.(10分)降凝剂H可以降低油品的凝固点,它是一种高分子聚合物,其合成路线可以设
计如下:
|
请回答下列问题:
(1)指出反应类型:① ,② 。
(2)写出结构简式:D , H 。
(3)写出E→F的化学方程式: 。
六、本题共2小题,19分
25.(6分)标准状况下,用一定量的水吸收HCl气体后制得浓度为11.8mol·L-1,密度为1.18g·cm-3的盐酸。试计算1体积水吸收多少体积的HCl气体可制得上述盐酸。(本题中HCl的式量以36.5计,水的密度为1.00g·cm-3计)
26.(13分)在室温下,向某一容积固定的真空容器内充入丁烷(气)和氧气,使容器内混合气的总压强达到P1,点火燃烧,丁烷和氧气恰好都完全反应,冷却至室温后容器内气体的总压强为P2。(以下计算结果保留两位有效数学)
(1)若丁烷燃烧的生成物只有H2O(液)和CO2,则![]() =
。
=
。
(2)若![]() =0.64,求反应后容器内所含各物质的物质的量之比和反应前混合气中丁烷的
=0.64,求反应后容器内所含各物质的物质的量之比和反应前混合气中丁烷的
物质的量分数。
高三期末综合测试
化学参考答案
一、(本题包括8小题,每小题3分,共24分)
1.D 2.C 3.A 4.C 5.D 6.B 7.A 8.B
二、(本题包括10小题,每小题5分,共50分)
9.D 10.B 11.B 12.B 13.C 14.AD 15.BC 16.C 17.C 18.AC
三、(共20分)
19.(8分)(1)NH3+CO2+H2O+NaCl(饱和)===NaHCO3+NH4Cl (2分)
(2)①(1分),⑧(1分),③⑦(答③⑦⑧同样给分),C(2分) (6分)
20.(12分)(1)H2O, CO, CO2。 (4分)
(2)稀硫酸,浓硫酸(各2分) (4分)
(3)关闭活塞b,旋开活塞a,让混合气缓慢通过甲瓶和乙瓶,片刻后在乙瓶导气管出口处用小试管收集气体检验CO纯度,合格后,用球胆或塑料袋收集CO。(4分)
四、(共21分)
21.(10分)(1)0 (2分) (2)-10 (2分) (3)2(7-pH) (2分) (4)9:11(4分)
22.(11分)(1)S,O (2分)
(2)2Na2S+Na2SO3+3H2SO4=3S↓+3 Na2SO4+3H2O (5分)
(3)2H++S2O32-====SO2↑+S↓+H2O (4分)
五、(共16分)
|
(2)6(2分) (1分)
24.(10分)(1)取代,消去 (2分)
|
|
六、(共19分)
25.(6分)1L这种盐酸的质量为m(盐酸)=1.18g·cm-3×1000cm3=1180g(2分)
1L这种盐酸中HCI的质量为m(HCl)=11.8×36.5·mol-1=431g
1L这种盐酸中水的质量m(H2O)=H80g-431g=749g
11.8molHCl气体在标准状况下的体积V=1180g×22.4L ·mol-1 =264L (2分)
1体积水吸收HCl气体的体积为![]() (2分)
(2分)
26.(13分)(1)0.53 (4分)
(2)设生成CO2的丁烷有xmol, 生成CO的丁烷有ymol, 则
C4H10+ 6.5O2 = 4CO2+ 5H2O(液)
xmol 6.5xmol 4xmol 5xmol
C4H10 +4.5O2 =4CO + 5H2O(液)
ymol 4.5ymol 4ymol 5ymol
![]()
则n(CO2):n(CO):n(H2O)=4x:4y:(5x+5y)=4×0.60y:4y:(5×0.60y+5y)=3:5:10 (5分)
![]()
(4分)