高三化学12月月考试卷
(时间:90分钟)
可能用到的相对原子质量: H: 1 O: 16 N: 14 Na: 23 Cl: 35.5 C: 12 K: 39 Al:27 S: 32 Fe: 56 Mg: 24 Cu: 64 F:19
第Ⅰ卷选择题(共50分)
一、选择题(下列各题只有一个选项最符合题意。每小题2分,共20分。请将答案填在答题卡上)
1.在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体。在同温同压下,两容器内的气体一定具有相同的
A.原子数 B.密度 C.质量 D.质子数
2.反应A+2B ![]() 2C(g);ΔH<0。当反应达到平衡后,同时升高温度和减小压又
2C(g);ΔH<0。当反应达到平衡后,同时升高温度和减小压又
达到新的平衡。若新平衡时混合物C的含量与原平衡相同,则下列推断正确的是
A.A一定不是气态物质 B.A一定是气态物质
C.B一定不是气态物质 D.B一定是气态物质
3.下列实验中①配制一定物质的量浓度的溶液;②用pH试纸测定溶液的pH;③过滤;④蒸发;⑤硫酸铜晶体里结晶水含量的测定,操作过程中均必须要用到的仪器是
A.烧杯 B.胶头滴管 C.玻璃棒 D.漏斗
![]() 4.在可逆反应2SO2(g)+O2(g)
4.在可逆反应2SO2(g)+O2(g)![]() 2SO3(g)+Q (△H<0) 达到新平衡时,在平衡体系中充入一定量的18O2,当达到新平衡时,18O的原子应存在于
2SO3(g)+Q (△H<0) 达到新平衡时,在平衡体系中充入一定量的18O2,当达到新平衡时,18O的原子应存在于
A.只能存在于O2的分子中 B.只能存在于SO3的分子中
C.能同时存在于SO2和O2的分子中 D.能同时存在于SO2、O2、SO3分子中
5.气体A、B分别为0.6 mol和0.5
mol,在0.4 L密闭容器中发生反应3A+B![]() mC+2D,经5
min后达到平衡,此时气体C为0.2 mol;又知在此反应时间内气体D的平均反应速率为0.1 mol/(L·min),下面结论正确的是
mC+2D,经5
min后达到平衡,此时气体C为0.2 mol;又知在此反应时间内气体D的平均反应速率为0.1 mol/(L·min),下面结论正确的是
A.平衡时反应混合物总物质的量为1 mol B.B的转化率为20%
C.A的平均反应速率为0.1 mol/(L·min) D.m值为4
6.短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A与C 在周期表中位置相邻,B原子最外层电子数等于A原子次外层电子数,下列叙述正确的是
A.原子半径A<B<C
B.A的氢化物的稳定性大于C的氢化物的稳定性
C.A的氧化物的熔点比B的氧化物的熔点高
D.A与C可形成离子化合物
7.下列各组物质在溶液中的反应,不管反应物的量的多少,都只能用一个离子方程式来表示的
A.FeBr2和C12 B.Ba(OH)2和H2SO4
C.HCl与Na2CO3 D.Ca(HCO3)2与NaOH
8.下列关于胶体的叙述不正确的是
A.布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区别开
B.光线透过胶体时,胶体发生丁达尔效应
C.用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
D.能电后溶液中溶质离子向两极移动,胶体中分散质粒子向某一极移动
9.关于氮化硅陶瓷的性能,下列说法不正确的是
A.是一种超硬物质,本身具有润滑性,并且耐磨损
B.抗腐蚀能力强,不与任何酸反应
C.耐高温而且不易传热
D.高温时也能抗氧化,且能抵抗冷热冲击
10.某同学在实验报告中记录下列数据,其中正确的是
A.用25mL量筒量取12.36mL盐酸
B.用托盘天平称取8.75g食盐
C.用标准的NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液23.10mL
D.用广泛pH试纸测得某溶液的pH为3.5
二、选择题(下列各题只有一个选项最符合题意。每小题3分,共30分。请将答案填在答题卡上)
11.有一种纽扣微型电池,其电极分别是Ag2O和Zn。电解池是KOH溶液,所以俗称银锌电池,该电池的电极反应式为Zn+2OH-+2e=Zn(OH)2,Ag2O+H2O+2e=2Ag+OH-下列说法,正确的是
①锌为负极,Ag2O为正极②放电时,正极附近pH值上升③放电时,负极附近溶液pH值降低④溶液中阴离子向正极方向移动,阳离子向负极方向移动
A.① B.①②④ C.①②③ D.①②③④
12.把aL含(NH4)2SO4和NH4NO3的混合液分成两等份,一份用bmol烧碱恰好把NH3全部赶出,另一份与cmol BaCl2使SO42-完全沉淀。则原混合液中NO3-离子的物质的量浓度为
A.(b-2c)/a mol•L-1 B.(2b-4c)/a mol•L-1
C.(2b-c)/a mol•L-1 D.(b-2a)/a mol•L-1
13.在容积为1 L的固定真空容器中,加入3.68 g N2O4无色晶体,升温至20℃,晶体逐渐气化成无色气体,并部分离解为红棕色的NO2气体,直至达到化学平衡,N2O4(g)![]() 2NO2(g),△H=57 kJ。从化学反应刚发生直到化学平衡的全过程中,以下量变化正确(温度不变)的是
2NO2(g),△H=57 kJ。从化学反应刚发生直到化学平衡的全过程中,以下量变化正确(温度不变)的是
A.气体总压强减少 B.气体的平均相对分子质量减少
C.气体的密度变大 D.气体的密度变小
14.下列各选项所述的两个量,前者一定大于后者的是
①F2和Br2的沸点 ②纯水在25℃和80℃时的pH值 ③同温下分别在100g水中最多能溶解的无水CuSO5和CuSO5·5H2O的质量 ④25℃时,等体积的PH值都等于3的盐酸和AlCl3溶液中,已电离的水分子数 ⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 ⑥耐火材料MgO和CaO的熔点 ⑦H-和H+离子半径 ⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数
A.①②⑥⑧ B.①②③⑤ C.②⑥⑦ D.⑤⑥⑦
15.将pH等于3的盐酸和pH等于11的氨水等体积混合后,溶液中离子浓度关系正确的是
A.c (NH4+)> c (Cl-)> c (H+)> c (OH-) B.c (NH4+)> c (Cl-)> c (OH-)> c (H+)
C.c (Cl-)> c (NH4+)> c (H+)> c (OH-) D.c (Cl-)> c (NH4+)> c (OH-)>c (H+)
16.在下列叙述中能说明盐酸是强酸,醋酸是弱酸的是
A.将pH=4的HCl和CH3COOH稀释成pH=5的溶液,CH3COOH需水量较多
B.HCl和CH3COOH均可用相应的钠盐与浓H2SO4反应制得
C.相同pH值的HCl和CH3COOH溶液中分别加入少量相应的钠盐固体,HCl溶液pH值不变而CH3COOH溶液pH值变大
D.相同pH值的HCl和CH3COOH溶液跟Zn反应,产生H2的起始速率相同
17.在恒温恒压下,向容积可变的密闭容器中充入3LA和2LB发生如下反应:3A(g)+2B(g)![]() xC(g)+yD(g)达到平衡时,混合气体中D的体积分数为W%,若维持温度、压强不变,将1.2LA, 0.8LB,3LC, 0.6LD作为起始物质充入密闭容器中,达到平衡时混合气体中D的体积分数仍为W%,则x, y的值分别为
xC(g)+yD(g)达到平衡时,混合气体中D的体积分数为W%,若维持温度、压强不变,将1.2LA, 0.8LB,3LC, 0.6LD作为起始物质充入密闭容器中,达到平衡时混合气体中D的体积分数仍为W%,则x, y的值分别为
A.x=3, y=1 B.x=2, y=3 C.x=4, y=1 D.x=5, y=1
18.已知下列物质在一定条件下氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO4-→Mn2+;Cl2→Cl-;HNO3→NO。如果分别用等物质的量这些物质氧化足量的KI,得到I2最少的是
A.Fe3+ B.MnO4- C.Cl2 D.HNO3
19.已知砷(As)是VA族元素,下列对砷及其化合物的叙述中,正确的是
A.砷的原子半径小于磷的原子半径
B.五氯化砷分子中每个原子都满足8电子稳定结构
C.单质砷很容易跟氢气反应生成相应的气态氢化物
D.砷酸的酸性比磷酸的酸性弱
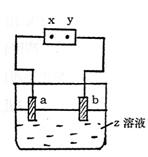
20.如图所示,x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色
|
|
第Ⅰ卷选择题答题卡
| 1 |
| 2 |
| 3 |
| 4 |
| 5 |
|
| 6 |
| 7 |
| 8 |
| 9 |
| 10 |
|
| 11 |
| 12 |
| 13 |
| 14 |
| 15 |
|
| 16 |
| 17 |
| 18 |
| 19 |
| 20 |
|
第Ⅱ卷非选择题(共50分)
三、填空简答题(本题26分)
21.(8分)在100℃时,将0.100mol的四氧化二氮气体充入1 L抽空的密闭容器中,隔一定的时间对该容器内的物质进行分析,得到如下表格:
| 浓度 | 时间 | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4)moL·L-1 | 0.100 | C1 | 0.0005 | C3 | a | b | |
| C(NO2)moL·L-1 | 0.000 | 0.060 | C2 | 0.120 | 0.120 | 0.120 | |
试填空:
(1)该反应的化学方程式为 。
达到平衡时四氧化二氮的转化率为 %。
表中C2 C3、a b(填 > < =)。
(2)20s时四氧化二氮浓度C1= moL·L-1。
0s~20s四氧化二氮的平均反应速率为 moL·L-1·s-1。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是 moL·L-1。
22.(8分)已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度远 大于第二步的电离程度,第二步的电离程度远大于第三步电离程度。……今有HA、H2B、H3C三种一元、二元、三元弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
①HA+HC2-(少量) A-+H2C-
②H2B(少量)+2A- B2-+2HA
③H2B(少量)+H2C- HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中酸性最强的是 。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子的是 ,最难结合质子的是 。
(3)判断下列反应的离子方程式中正确的是(填写标号) 。
A.H3C+3A- 3HA+C3- B.HB-+A- HA+B2-
C.H3C+B2- HB-+H2C-
(4)完成下列反应的离子方程式
A.H3C+OH-(过量): 。
B.HA(过量)+C3- 。
23.(10分)1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。
(1)下列热化学方程中,能直接表示出氯化钠晶体格能的是 。
A.Na+(g)+Cl-(g) NaCl(s); △H B.Na(s)+![]() Cl2(g)
Cl2(g) NaCl(s); △H1
C.Na(s) Na(g); △H2 D.Na(g)-e- Na+(g);
△H3
E.![]() Cl2(g)
Cl2(g) Cl(g); △H4 F.Cl(g)+e- Cl-(g); △H5
(2)写出△H1与△H、△H2、△H3、△H4、△H5之间的关系式 。
氧化亚铁晶体结构与氯化钠晶体结构相似,则:
(3)氧化亚铁晶体中,跟二价铁离子紧邻且等距的氧离子个数是 ,跟二铁离子紧邻且等距的二价铁离子个数是 。
(4)设阿伏加德罗常数值为NA,若氧化亚铁的密度为ρg/cm3,则氧化亚铁晶体中二价离子与氧离子之间最近距离是 cm(用代数式表示)
(5)若氧化亚铁晶体中有3n个二价铁离子被2n个三价铁离子所替代,该晶体中氧离子的数目将_____ (填“减少”、“增多”或“保持不变”)。
四、实验题(本题16分)
24.(5分)Ca3(PO4)2 、CaHPO4 均为难溶于水的白色固体。某同学向Na2HPO4 溶液中滴加CaCl2 溶液至恰好反应,生成白色沉淀。试设计一个简单的实验方案,来证明所生成的白色沉淀是Ca3(PO4)2 还是CaHPO4
实验原理:
。
实验用品及试剂:烧杯、玻璃棒、试管;石蕊试液、酚酞、PH试纸
实验步骤、现象、结论(可不填满):
A.___________________________________________________________
B.__________________________________________________________
C.__________________________________________________________
D.__________________________________________________________
25.(11分)实验室用浓盐酸、二氧化锰共热制氯气,并用氯气和Ca(OH)2制取少量漂白粉。现已知反应:2Cl2+2Ca(OH)2 Ca(ClO)2+CaCl2+2H2O,该反应是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O。
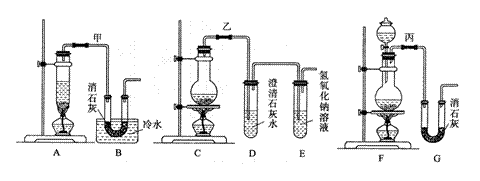 现有3个同学分别设计的3套实验装置如下图:
现有3个同学分别设计的3套实验装置如下图:
(1)写出制取氯气的化学方程式 。
(2)请从以下几个方面对甲乙丙3套实验装置的优缺点作出评价,并将符合题目要求的选项的序号填在表中空格中。
a.不容易控制反应速率;b.容易控制反应速率;c.有副反应发生;d.可防止副
反应发生;e.污染环境;f.可防止污染环境。
| 优 点 | 缺 点 | |
| 甲装置 | ||
| 乙装置 | ||
| 丙装置 |
(3)上述装置中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分
组成,请从上述装置中选取合理的部分,组装一套较完整的实验装置,装置各部分
连接顺序是 (按气流流动的方向)。该组合中还缺少的
装置是 ,原因是 。
(4)实验室若用16mol/L的盐酸100mL与足量的二氧化锰反应,理论上最终生成的次氯酸钙的物质的量最多不超过 mol。
五、计算题(本题8分)
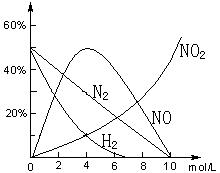 26.(8分)实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物。例如,镁与硝酸反应实验中,测得其气相产物有H2、N2、NO、NO2,液相产物有Mg(NO3)2,NH4NO3和H2O。生成这些产物的HNO3浓度范围为:H2:C<6.6mol/L;N2和NH4+:C<10mol/L;NO:0.1mol/L<C<10mol/L;NO2:C>0.1mol/L。各气相产物成分及含量随HNO3浓度变化曲线如右图所示。
26.(8分)实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物。例如,镁与硝酸反应实验中,测得其气相产物有H2、N2、NO、NO2,液相产物有Mg(NO3)2,NH4NO3和H2O。生成这些产物的HNO3浓度范围为:H2:C<6.6mol/L;N2和NH4+:C<10mol/L;NO:0.1mol/L<C<10mol/L;NO2:C>0.1mol/L。各气相产物成分及含量随HNO3浓度变化曲线如右图所示。
(1)写出少量Mg与11mol/L的HNO3反应的方程式;
(2)960 mg Mg与1L 4mol/L的HNO3完全反应,收集到224 mL气体(S.T.P)气体,试通过计算写出反应方程式。
参考答案
第Ⅰ卷选择题答题卡
| 1 | A | 2 | C | 3 | C | 4 | D | 5 | B |
| 6 | B | 7 | B | 8 | A | 9 | B | 10 | C |
| 11 | C | 12 | A | 13 | B | 14 | C | 15 | B |
| 16 | C | 17 | D | 18 | A | 19 | D | 20 | A |
21.
(1) N2O4(g)![]() 2NO2(g) 60% C2>C3 a=b
2NO2(g) 60% C2>C3 a=b
(2)0.07 ,0.0015 (3) 0.2
22.(1)H2B (2)C3-;HB-; (3)B、C
(4)A:H3C+3OH-=C3-+3H2O B:2HA+C3-=2A-+H2C-
23.(1)A或△H
(2)△H1=△H+△H2+△H4+△H5 (3)6个, 12个 (4)![]() (5)不变
(5)不变
24.(1)原理:若生成物的混合物显强酸性,则生成的沉淀为Ca3(PO4)2
2Na2HPO4 +3CaCl2 =Ca3(PO4)2 +4NaCl +2HCl
若生成物的混合物不显酸性,则生成的沉淀为CaHPO4
Na2HPO4+CaCl2=CaHPO4+2NaCl
(2)A.在Na2HPO4 溶液中滴加过量的氯化钙溶液
B.沉淀静置
C.用玻棒沾取上层澄清液到pH试纸上,若溶液呈酸性,则证明生成的沉淀为Ca3(PO4)2 ;反之则为CaHPO4
25.(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(2)
| 优 点 | 缺 点 | |
| 甲装置 | d | a,e |
| 乙装置 | f | a,c |
| 丙装置 | b | c,e |
(3)F、B、E;还缺少除去氯气中的氯化氢杂质的装置;因为氯化氢可以与Ca(OH)2
和Ca(ClO) 2反应
(4)0.2
26.(1)Mg+4HNO3=Mg(NO3)2+2NO2↑+2H2O
(2)40Mg+100HNO3=5NO↑+H2↑+NO2↑+3N2↑+4NH4NO3+40Mg(NO3)2+41H2O
(提示:本题考查识图能力、图象的定量分析、氧化还原反应得失电子守恒、方程式比例系数的确定。由图象可知:nNO:nN2:nNO2:nH2=5:3:1:1,同时还原产物还有NH4+,并通过得失电子相等确定与前者的关系。)