高三化学 “一诊”考试
化学试卷
说明:
1. 本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,第I卷1—2页,第Ⅱ卷3—6页将第I卷的正确选项用铅笔涂写在答题卡上,第Ⅱ卷用钢笔或圆珠笔直接答在试题卷上,答卷前请将密封线内的项目填写清楚。
2. 本试卷满分110分,90分钟完卷。
可能用到的相对原子质量:H-- 1 C--12 N-- 14 O-- 16 Na -- 23 Cl-- 35.5
第I卷(选择题 共48分)
一、选择题(本题包括12个小题,每小题4分,共48分。每小题只有一个选项符合题意。)
1.有人认为在元素周期表中,位于第IA族的氢元素,也可以放在VIIA族。下列物质能支持这种观点的是 ( )
A.HF B. H3O+ C. NaH D. H2O2
2.为了使经济可持续发展,生产过程应尽可能减少对环境的负作用。由单质铜制取硫酸铜有下列几种方案,其中可行且符合以上要求的是 ( )
A. Cu → CuSO4 B. Cu → CuO→CuSO4
C. Cu→ Cu2(OH)2CO3 D.Cu→ Cu(NO3)2→Cu(OH)2 → CuSO4
3.下列实验中,直接使用内壁沾有水滴的仪器,对实验结果没有影响的是 ( )
A.氨的喷泉实验:烧瓶 B。 实验室制取氧气:试管
C。中和滴定:锥形瓶 D。硫酸铜晶体里结晶水含量的测定:研体
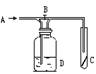
4. 右图是一种试验某气体休学性质的实验装置,图中B为开关。
如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是 ( )
A.浓NaOH溶液 B.浓NaBr溶液
C.饱和NaCl溶液 D。浓H2SO4
5.下列离子方程式书写正确的是
A. 次氯酸钙溶液中通入过量的二氧化碳
Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
B. 用氨水与少量的二氧化硫反应 NH3·H2O+SO2=NH4++HSO3-
C. 硝酸铁溶液中加入过量氨水 Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
D.氢氧化钡溶液中滴加稀硫酸 Ba2++SO42-=BaSO4↓
6.铯(Cs)是核电荷数较多的碱金属元素,下列关于铯及其化合物的叙述,不正确的是
A. 常温下铯是略带金色光泽的固体 B.铯与冷水反应,会在水下面发生剧烈爆炸
C.铯可与氧形成多种氧化物 D.铯的氧化物可直接与水反应生成CsOH
7.在一密闭容器中,反应a A(g) ![]() b B(g)达到平衡后,保持温度不变,将容器体积增大一倍,达到新的平衡时,B的浓度是原来的60%。则下列说法正确的是
b B(g)达到平衡后,保持温度不变,将容器体积增大一倍,达到新的平衡时,B的浓度是原来的60%。则下列说法正确的是
A.物质A的转化率减小了 B.平衡向正反应方向移动了
 C.物质B的质量数减小了 D.a﹥b
C.物质B的质量数减小了 D.a﹥b
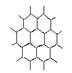
8.石墨晶体的结构俯视图如右图所示。在石墨晶体中,C原子数与C—C鍵数之比是
A.2︰3 B. 3︰2 C. 1︰1 D. 1︰2
9.下列各组物质均为无色溶液,不用其他试剂就能鉴别出来的是
①NaOH[天河科技1] [天河科技2] (aq)和Al2(SO4)3(aq) ②NH3(aq)和AgNO3(aq)
③Na2CO3(aq)和HCl(aq) ④HCl(aq)和NaAlO2(aq)
A.①②③ B.②③④ C. 全部 D. 均不能
10.[天河科技3] 在短周期元素X和Y中,X原子的最外层电子数是内层电子总数的一半,Y元素在X的前一周期,Y2-离子和Ne原子的电子层结构相同。关于X和Y形成的化合物Z的说法正确的是
A.Z是一种酸性氧化物 B.Z是一种碱性氧化物
C.Z的分子式一定是X2Y5 D.Z是一种离子化合物
11.在一定条件下,将m体积NO和n体积O2同时通入倒立于水中且盛满水的容器内,充分反应后,容器内残留m/2体积的气体,该气体与空气接触后变为红棕色,则m与n的比值是
A..3︰2 B. 2︰3 C. 8︰3 D.3︰8
12.Ph=13的强碱溶液和Ph=2的强酸溶液混合,所得混合液的Ph=11,则强碱溶液与强酸溶液的体积比是
A.11︰1 B.9︰1 C.1︰11 D.1︰9
第Ⅱ卷(非选择题 共62分)
二、(本大题共10分)
 13.(10分)50mL0.25mol·L-1硫酸与50 mL0.56mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
13.(10分)50mL0.25mol·L-1硫酸与50 mL0.56mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)右图装置与中学教材上实验装置相比较,尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎泡沫塑料的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”、无影响)。
(4)若实验过程中,测得硫酸和NaOH溶液的起始温度的平均值为25.2℃,溶液混合后的最高温度为28.6℃,混合溶液的比热容c (4.18 J/g·℃),硫酸和NaOH溶液的密度都认为是1g·cm-3。则该中和反应的热化学方程式为 。
(5)实验中改用60mL 0.25mol/L硫酸与50mL 0.56mol/L NaOH溶液进行反应,与上述实验相比,所求中和热 (填“相等”或“不相等”)。
(6)若用50mL 0.25mol/L硫酸与50mL0.56mol/L氨水进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”、“不变”)。
三、(本大题包括2小题,共22分)
14.(10分)已知在0.1mol/L的NaHSO3溶液中有关粒子浓度由大到小的顺序是:
c(Na+)﹥c(HSO3-)﹥c(SO32-)﹥c(H2SO3)。
(1)则该溶液中c(H+) c(OH-)(填“﹥”、“﹦”、“﹤”),简述理由
。
(2)现向NaHSO3溶液中,逐渐加入少量含有酚酞的NaOH溶液,可以观察到的现象是 ,写出该反应的离子方程式 。
15.(12分)从某盐A的水溶液中出发,有下图所示的一系列变化(参加反应或生成的H2O均末列出)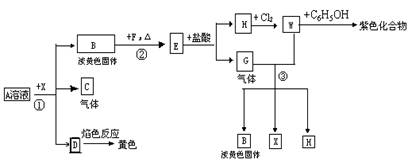
据图回答下列各有关问题:
(1) 写出有关物质的化学式
A ,C ,X 。
(2)反应①的离子方程式是 。
反应②的化学方程式是 。
(3)在反应③中,氧化剂与还原剂的物质的量之比是 。
四、(本大题包括2小题,共20分)
16.(8分)有机物甲、乙的结构简式分别是:
甲:CH3COOCH2CH2OOCCH3
乙:C2H5OOCCOOC2H5
(1)甲和乙的关系是 (填所选选项的代号)。
A.同一物质 B.同分异构体 C.同系物
(2) 通过以下途径可以合成甲、乙(反应条件已略去):
甲![]() X
X ![]() Y
Y ![]() Z
Z ![]() 乙+CH3COOH +O2
乙+CH3COOH +O2
试写出:X的结构简式 、反应④的化学方程式
若X与Z在一定条件下可以形成分子式为C4H4O4的酯,则该酯的结构简式为
。
17.(12分)由本题所给①、②两条信息,结合已学过的知识 ,回答下列问题。
①![]() (环戊烯)可简写为
(环戊烯)可简写为![]() ,其化学性质与烯烃相似。
,其化学性质与烯烃相似。
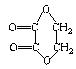
②烯烃可以与臭氧(O3)反应,再在锌粉存在下水解即可将原有的烯键断裂,断裂处两端的碳原子各结合一个氧原子而生成羰基(![]() )。这两步反应合在一起,称为“烯键臭氧分解”。如:
)。这两步反应合在一起,称为“烯键臭氧分解”。如:
a.(CH3)2C=CHCH3 ![]() (CH3)2C=O+CH3CHO
(CH3)2C=O+CH3CHO
b. ![]()
(1)请写出异戊二烯(![]() )发生臭氧分解得到的各种产物的结构简式 ,其物质的量之比是 。
)发生臭氧分解得到的各种产物的结构简式 ,其物质的量之比是 。
(2)某有机物A(C6H8)在一定条件下与足量氢气反应可生成饱和有机物B(C6H12),若将A进行“臭氧分解”时,只生成丙二醛![]() 则:
则:
A的结构式为 ,A→B的反应类型为 。
(3)a mol某烃CnH2n-2(分子中无—C≡C—和 ) 结构)发生臭氧分解后,测得有机物中含有羰基bmol,则a和b的代数关系是 或 。H2O
五、(本大题共10分)
18(10分)已知NaCl在60○C时的溶解度为37·1g,现有60○C时的经净化的饱和食盐水685·5g,用“离子交换膜法”将其电解以制取烧碱。电解一段时间后得到密度为1·37g/mL的溶液630g。
(1)电解得到的NaOH主要产生在 区(填“阴极”或“阳极”)。
(2)写出电解NaCl溶液的化学方程式 。
(3)685·5g饱和食盐水中NaCl的质量为 g。
4)电解后溶液中NaCl的物质的量的浓度是多少?
德阳市高2004届“一诊”考试化学
参考答案与评分标准
一、选择题(第题4分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | C | B | C | C | C | B | B | A | C | A | C | D |
二、(本大题共10分)
13(1)环形玻璃搅拌棒(1分)
(2)防止热量散失(1分)
(3)偏小(1分)
(4)NaOH (aq) + 1/2 H2SO4 (aq) == 1/2 Na2SO4(aq ) + H2O (l) ; △H= -56.85KJ/mol (3分)
或OH-(aq) + H+(aq) = H2O(l) ; △H= -56.85KJ/mol
(5) 相等
(6)偏小
三、(本大题共22分)
14.(1)>(2分)理由是:HSO3-在溶液中同时存在电离平衡(HSO3-![]() H++SO32-)和水解平衡(
H++SO32-)和水解平衡(
HSO3-+H2O![]() H2SO3+OH-),由题中信息知c(SO32-)>c(H2SO3),说明电离程度大于水解程度,则c(
H2SO3+OH-),由题中信息知c(SO32-)>c(H2SO3),说明电离程度大于水解程度,则c(
H+)>c(OH-)(4分)
(3) 原溶液仍为无色,所加溶液的红色褪去(2分) HSO3-+OH-=SO32-+H2O(2分)
15.(12分,每空各2分)
(1)A.Na2S2O3 C.SO2 X..HCl
(2)①S2O32-+2H+=S↓+SO2↑+H2O ②Fe+S ![]() FeS[天河科技4]
FeS[天河科技4]
(3)2︰1
四、(本大题共20分)
16.(8分,每空2分)
(1)B (2)X·HOCH2CH2OH 
17.(12分,每空2分)
(1)HCHO和![]() ,2︰1 (2)
,2︰1 (2)![]() 加成反应或还原反应 (3)b=2a或b=4a
加成反应或还原反应 (3)b=2a或b=4a
五、(共10分)【(1)、(2)、(3)各2分,(4)4分】
18.(1)阴极 (2)2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑ (3)185·5g
2NaOH+H2↑+Cl2↑ (3)185·5g
(4)电解后溶液中NaCl的物质的量为:n(NaCl)=1·65mol
其溶液的体积为:V=0·46L
所以电解后溶液中NaCl的物质的量的浓度为:c(NaCl)=3·59mol·L-1
答:电解后溶液中NaCl的物质的量浓度为3·59mol·L-1。(酌情给步骤分)
[天河科技1]
[天河科技2]
[天河科技3]
[天河科技4]