高三化学《电化学》试卷
(时间:50分钟。满分100分)
可能用到的相对原子质量: H: 1 O: 16 N: 14 Na: 23 Cl: 35.5 C: 12 Ca: 40
Cu:64 S: 32 Fe: 56 Ag: 108 Zn:65
一、选择题(下列各题只有一个选项符合题意。每小题4分,共60分。请将答案填在答题卡上)
1.随着人们生活质量的不断提高,废电池必须进行集中处理的问题,被提高到议事日程,其首要原因是
A.利用电池外壳的金属材料
B.防止电池中汞,镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极
2.下列叙述正确的是
①锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速度;②镀层破损后,白铁(镀锌铁)比马口铁(镀锡铁)更易腐蚀;③电镀时,应把镀件置于电解池的阴极;④冶炼铝时,把氧化铝加入液态冰晶石中成为熔融体后电解⑤钢铁表面常易锈蚀生成Fe2O3·nH2O
A.①②③④⑤ B.①③④⑤ C.①③⑤ D.②④
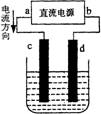 3.右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
3.右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
A.a为负极、b为正极 B.a为阳极、b为阴极
C.电解过程中,d电极质量增加 D.电解过程中,氯离子浓度不变
4.用惰性电极实现电解,下列说法正确的是
A.电解稀硫酸溶液,实质上是电解水,故溶液p H不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
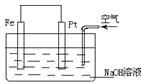 5.对于右图所示装置的叙述正确的是
5.对于右图所示装置的叙述正确的是
A.这是一个原电池的装置
B.这是电解NaOH溶液的装置
C.Pt为正极,其电极反应为:2H++ 2e-=H2↑
D.Fe为负极,其电极反应为:4OH-- 4e-=2H2O + O2↑
6.能够使反应Cu+2H2O=Cu(OH)2↓+H2↑发生的是
A.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
B.铜锌合金在潮湿的空气中发生电化学腐蚀
C.用铜片作阴、阳电极,电解硫酸钠水溶液
D.用铜片作阴、阳电极,电解硫酸铜水溶液
7.氢氧燃料电池是一种高性能电池,总反应为2 H2 + O2 = 2 H2O,电解质溶液为KOH溶液,下列有关该电池的叙述中不正确的是
A.H2为负极,O2为正极 B.工作时电解质溶液的PH不断增大
C.负极反应:2H2-4e- +4OH-=4H2O D.正极反应:O2 + 4e- +2 H2O=4OH-
8.铁棒与石墨棒用导线连接后,浸入0.01mol/L的食盐溶液中,可能出现的现象是
A.铁棒附近产生OH- B.铁棒被腐蚀
C.石墨棒上放出Cl2 D.石墨棒上放出O2
9.用惰性电极电解饱和Na2CO3溶液,若保持温度不变,则一段时间后
A.溶液的pH不变 B.c(Na+)与c (CO32-)的比值变大
C.溶液浓度变大,有晶体析出 D.溶液浓度不变,有晶体析出
10.用铂作电极电解一定浓度的下列物质的水溶液.电解结束后,向剩余电解液中加适量水,能使溶液和电解前相同的是
A.AgNO3 B.CuSO4 C.NaOH D.NaCl
11.A、B、C是三种金属,根据下列①、②两个实验:①将A与B浸在稀H2SO4中用导线相连,A上有气泡逸出B逐渐溶解;②电解物质的量浓度相同的A、C的盐的混合溶液时,阴极上先析出C,(使用惰性电极),确定它们的还原性强弱顺序为
A.A>B>C B.B>C>A C.C>A>B D.B>A>C
12.用石墨电极电解硝酸银溶液,在阳极收集到0.4g氧气,中和电解时生成的酸需250mL某氢氧化钠溶液,则氢氧化钠溶液的浓度是
A.0.20mol·L-1 B.0.15mol·L-1 C.10mol·L-1 D.0.05mol·L-1
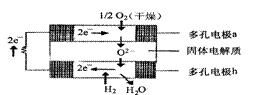 13.固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2- )在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是
13.固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2- )在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是
A.有O2参加反应的a极为电池的负极
B.有H2参加反应的b极为电池的正极
C.a极对应的电极反应式为O2+2H2O-4e=4OH-
D.该电池的总反应方程式为:2H2+O2=2H2O
14.用铂电极电解NaCl和CuSO4的混合溶液,当电路中通过4mol电子电量时,阴、阳两极都产生1.4mol气体,电解后溶液体积为4L,则最后电解液的pH值最接近
A.4 B.2 C.13 D.14
15.有一种纽扣微型电池,其电极分别是Ag2O和Zn。电解池是KOH溶液,所以俗称银锌电池,该电池的电极反应式为Zn+2OH-+2e=Zn(OH)2,Ag2O+H2O+2e=2Ag+OH-下列说法,正确的是①锌为负极,Ag2O为正极 ②放电时,正极附近pH值上升③放电时,负极附近溶液pH值降低④溶液中阴离子向正极方向移动,阳离子向负极方向移动
A.① B.①②④ C.①②③ D.①②③④
班级 姓名 成绩
选择题答题卡
| 1 |
| 2 |
| 3 |
| 4 |
| 5 |
| 6 |
| 7 |
| 8 |
|
| 9 |
| 10 |
| 11 |
| 12 |
| 13 |
| 14 |
| 15 |
|
| |
二、填空简答题(共27分)
16.(4分)熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3、Na2CO3和的熔融盐混和物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极助燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:电池反应式:阳极反应式:2CO+2CO32- →4CO2+4e-。
阴极反应式: ,总电池反应: 。
17.(4分)用石墨作电极电解3mol/LNaCl和0.4mol/LAl2(SO4)3的混合液时,下图曲线正确的是( )

 |
18.(5分)如图所示,在U形管中加入Na2SO4溶液,再加入几滴石蕊试液,插入惰性电极,接通电源。
(1)一段时间后可观察到的现象是 。
(2)切断电源,取出电极,将在U形管中的溶液倒入一小烧杯中,搅拌,可观察到的现象是 ,其原因是 。
(3)若改用该装置电解滴有几滴酚酞试液的饱和Na2CO3溶液,一段时间后可观察到阳极 ,阴极 。
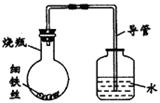 19.(6分)某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如
19.(6分)某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如
|
不同时间水面上升的高度
| 时间/小时 | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| A瓶(盛干燥铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| B瓶(盛沾了食盐水的铁丝) | 0 | 0.4 | 1.2 | 3.4 | 5.6 | 7.6 | 9.8 |
| C瓶(盛沾了清水的铁丝) | 0 | 0 | 0 | 0.3 | 0.8 | 2.0 | 3.5 |
| D瓶(盛完全浸没在食盐水中的铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
课题组在结题时,学校评审组组织了成果展示与答辩,假如你是课题组组长,请回答以下的问题:
(1)导管中水面为什么会上升 。
(2)上述实验中,铁丝生锈的速率由大到小的排列顺序为(填小烧杯号) 。
(3)影响钢铁生锈的因素主要有 。
20.(8分)关于“电解CuCl2溶液时的pH值变化”问题,化学界有以下两种不同的观点:
观点一是,“理论派”认为电解CuCl2溶液后溶液的pH值升高。
观点二是,“实验派”经过反复多次、精确的实验测定,证明电解CuCl2溶液时pH值的变化有如图所示的曲线关系.请回答下列问题:
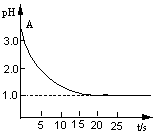 (l)电解前CuCl2溶液的pH值处于A点位置的原因是(用离子方程式明)
。
(l)电解前CuCl2溶液的pH值处于A点位置的原因是(用离子方程式明)
。
(2)“理论派”所持观点的理论依据是
。
(3)“实验派”的实验结论是 ,他们所述“精确的实验”是通过 来准确测定溶液的pH值的。
(4)你持何种观点?你所持观点的理由是(从化学原理上加以简述) 。
三、计算题(共13分)
![]() 21.(6分)蓄电池是一种可以反复充电、放电的装置,有一种蓄电池在充电和放电时发生的
21.(6分)蓄电池是一种可以反复充电、放电的装置,有一种蓄电池在充电和放电时发生的
反应是:NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2
用该蓄电池进行电解M(NO3)x溶液时:
(1)电解池的阳极(惰性)应连接 (填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
若此蓄电池工作一段时间后消耗0.36g水。
(2)电解M(NO3)x溶液时某一极增至mg,金属M的相对原子质量的计算式为
(用m、x表示) 。
(3)此蓄电池电解含有0.01mol CuSO4和0.01mol NaCl的混合溶液100mL,阳极产生气体
L(标准状况),电解后溶液加水释至1L,溶液的pH为 。
22.(7分)向8g二价金属的氧化物固体中加入稀H2SO4,使其恰好完全溶解,已知所耗的硫酸体积为100mL,在所得溶液中插入铂电极进行电解,通电一定时间后,在一个电极上收集到224mL(标准状况)氧气,在另一个电极上析出该金属1.28g。
(1)根据计算确定金属氧化的名称。
(2)计算通电后硫酸溶液的物质的量浓度(溶液体积按100mL计算)。