高三化学《几种重要的金属》试卷
(时间:50分钟 满分100分)
可能用到的相对原子质量: H: 1 O: 16 N: 14 Na: 23 Cl: 35.5 C: 12 Ca: 40 Cu:64 S: 32 Fe: 56 Mg: 24 Al: 27 Zn:65
一、选择题(下列各题只有一个选项符合题意。每小题4分,共60分。请将答案填在答题卡上)
1.铝和镁比较,铝的硬度较大,熔点和沸点较高.这是因为
A.镁的核电荷数较大,原子量较大 B.镁离子和自由电子的作用力较弱
C. 铝离子所带的正电荷比镁离子的多 D. 铝的原子半径较大
2.能说明镁比铝还原性强的事实是:
A.Mg的价电子比铝少 B.镁带在空气中和CO2中能燃烧,而铝不能
C.Mg遇浓硫酸不钝化,而铝钝化 D.铝的硬度、延展性、熔点均比镁大、好、高
3.铁片投入下列溶液后,金属片质量减少,但无气体放出的是
A.冷、浓HNO3 B.Cu(NO3)2 溶液
C.稀HNO3 D.Fe(NO3)3溶液
4.下列离子方程式正确的是
A.FeBr2 溶液中加入过量氯水: 2Fe2+ +Cl2 = 2Fe3++2Cl-
B.铁粉和FeCl3 溶液反应: Fe + Fe3+ = 2Fe2+
C.铁粉和过量的稀HNO3 反应: Fe+NO3-+4H+ = Fe3+ +NO ↑+2H2O
D.Mg(HCO3)2 溶液 与过量 NaOH 溶液反应:
Mg2++2HCO3-+2OH- = MgCO3 ↓ + CO32-+2H2O
5.向下列溶液中加入氨水直至过量,最终能得到无色澄清溶液的是
A.Al2(SO4)3溶液 B.AgNO3溶液 C.CuSO4溶液 D.MgCl2溶液
6.有甲、乙、丙、丁四种金属,将甲、乙用导线相连放人稀硫酸中可以看到乙慢慢溶解,而甲的表面有气泡逸出;把丁放到乙的硝酸盐溶液中后,丁表面覆盖一层乙的单质;用石墨电极电解含有相同物质的量浓度的甲和丙两种金属的盐溶液,丙的单质先析出;将甲放入稀盐酸中有H2析出,已知四种金属中有一种是铜,根据以上实验判断铜是
A.甲 B.乙 C.丙 D.丁
7.甲、乙、丙、丁分别是Al2(SO4)3,FeSO4 ,NaOH ,BaCl2 四种物质中的一种。若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是
A.Al2(SO4)3 B.FeSO4 C.NaOH D.BaCl2
8.Cu+在酸性溶液中可发生自身氧化-还原反应生成Cu2+和单质铜,若要检验用氢气还原氧化铜所得的红色产物中是否含有Cu2O,应选用的试剂和相对应的实验现象正确的是
A.浓H2SO4,是否有无色气体生成 B.稀HNO3,是否生成蓝色溶液
C.稀H2SO4,固体物质是否溶解 D.稀HCl,是否生成蓝色溶液
9.一定量的Fe 和Fe2O3 混合物投入250 ml 2 mol/L 的 HNO3 溶液中, 反应完全后, 无固体剩余, 生成1.12L NO气体 (标况), 再向反应后溶液中加入1 mol/L 的 NaOH 溶液, 要使铁元素全部沉淀下来, 所加NaOH 溶液的体积最少的是
A.450ml B.500 ml C.400 ml D.无法确定
10.向明矾溶液中滴入Ba(OH)2溶液,当SO42-恰好沉淀完全时,这时铝元素较大量的存在形式是
A.Al(OH)3和Al3+ B.Al(OH)3和AlO2- C.Al(OH)3 D.AlO2-
11.下列各组离子在溶液中不能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶液的是
A.Fe3+、CI-、Na+、SO42- B.Al3+、Na+、CO32-、NO3-
C.Ag+、Na+、SO42-、NO3- D.AlO2-、CO32-、K+、Na+
12.碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜,在高温下这两种化合物均能分解生成氧化铜,溶解28.4g上述混合物,消耗1mol·L-1盐酸500mL,灼烧等量的上述混合物,得到氧化铜的质量是
A.35g B.30g C.20g D.15g
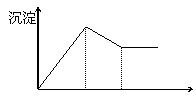
|
中不断加入NaOH溶液,得到的沉淀量与加
入的NaOH溶液的关系如图所示,则溶液中
c(Cl¯)与c(SO42-)之比为
A.1∶1
B.2∶3
C.3∶2 D.2∶1
14.某研究性学习小组想用实验证明高锰酸钾溶液的紫红色是MnO4-离子的颜色,而不是K+离子的颜色。他们设计的下列实验步骤中没有意义的是
A.将高锰酸钾晶体加热分解,所得固体质量减少
B.观察氯化钾溶液没有颜色,表明溶液中K+无色
C.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+无反应
D.在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫红色褪去,表明MnO4-离子为紫红色
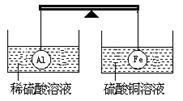 15.在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻,如图,则下列说法正确的是
15.在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻,如图,则下列说法正确的是
A.铝球一定是空心的
B.左边烧杯中的溶液质量减少了
C.去掉两烧杯杠杆仍平衡
D.右边铁球上出现红色
班级 姓名 成绩
选择题答题卡
| 1 |
| 2 |
| 3 |
| 4 |
| 5 |
| 6 |
| 7 |
| 8 |
|
| 9 |
| 10 |
| 11 |
| 12 |
| 13 |
| 14 |
| 15 |
|
| |
二、填空简答题(共12分)
16.(6分)按要求回答下列问题:
(1)长期加热煮沸暂时硬水所形成的水垢的主要成分是 。
(2)钢铁在潮湿的空气中生锈,有关的电极反应方程式为:
负极: ,正极: 。
(3)冶金工业上用金属铝和V2O5制取金属钒的化学方程为 。
(4)只用一种试剂可以把Fe、FeO、FeS、CuO、C、MnO2六种黑色粉末鉴别出来,该试剂是 。
(5)实验室配制硫酸亚铁溶液时,先将其晶体溶于稀硫酸中,其原因是 。
(6) 1.6gCu与某浓度硝酸50ml充分反应,Cu完全溶解,反应后溶液(设仍为50ml)中 H+浓度为a mol·L-1,则此时溶液中NO3- 的物质的量为 mol。
17.(6分)实验室分析白铁(镀锌的铁)样品成分,称取1.00g样品放在烧杯中,加入过量盐酸,然后用玻璃片盖住烧杯,首先观察到大量气体冒出,后来放出气体速率变慢,最后完全反应。接着加入过量的NaOH溶液,过滤分离出灰绿色沉淀,该沉淀在空气中加热至质量不变,最后得到1.20g红色粉末。
(1)白铁镀锌的作用是________ _;盖玻璃片的作用是_______ _______。
(2)放出气体速率由快变慢的原因是____ __________。
(3)为什么要加入过量NaOH溶液_____ _________。
(4)锌在样品中的百分含量是______________。
三、实验题(共26分)
18.(12分)实验室有CuO和Cu粉的混合物。请你利用给出的实验仪器及试剂,设计两种测定该样品(已称得其质量为m克)中氧化铜质量分数的方法,并填写表格中的有关内容。
| 实验 方法 | 实验过程中所发生反应的 化学方程式 | 实验所用仪器 (用编号表示) | 实验需直接测定的有关物理量 (用文字说明) |
| 1 | |||
| 2 |
实验可能用到的主要仪器:
①托盘天平 ②启普发生器 ⑧硬质玻璃管 ④泥三角 ⑤烧杯
⑥坩埚 ⑦酒精灯 ⑧玻棒 ⑨漏斗 ⑩干燥管
实验可能用到的试剂:a.锌粒 b.稀硫酸 c.氯化钠溶液 d,浓硫酸
19.(14分)某研究性学习小组设计了下面三种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
 方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
方法三:应用右图所示的电解实验可以制得白色的纯净的
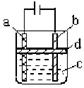 Fe(OH)2沉淀.两电极材料分别为石墨和铁。
Fe(OH)2沉淀.两电极材料分别为石墨和铁。
(1)a电极材料应为 ,电极反应式为 。
(2)电解液C可以(填编号)是 。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用是 ,在加入苯之前对C应作何简单处理 。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号) 。
A.改用稀硫酸作电解液 B.适当增大电源的电压
C.适当减小两电极间的距离 D.适当降低电解液的温度
(5)若C中用Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一现象是 。
四、计算题(共8分)
20.(8分)把一支表面被氧化成10.2g氧化铝的铝条A,放入1L1.5mol/L热氢氧化钠溶液中,过一段时间后取出铝条,溶液质量增加了12.6g,此时的溶液称为甲溶液,体积仍为1L。再把另一支表面也被氧化的一定量的铝条B,放入1L0.9mol/L硫酸溶液中,过一会儿取出,其质量减小了25.8g,溶液的质量增加了25.2g,此时的溶液称为乙溶液,体积仍为1L。回答下列问题:
(1)甲溶液的溶质是________________(写化学式),其物质的量_____________________。
(2)乙溶液的溶质是_______________________(写化学式),其物质的量是__________。
(3)将甲、乙两溶液反应,若使滴加的量最少,而产生的沉淀最多,应将________溶液
______L滴加到_________溶液(用“甲”或“乙”填写),产生的沉淀最多是________g。