高考能力测试步步高化学基础训练28
基础训练28 盐类的水解
(时间60分钟,赋分100分)
●训练指要
本训练点包括:盐类水解的实质及离子方程式的书写;判断溶液中离子是否共存及粒子浓度的大小;盐类水解的应用。
一、选择题(每小题5分,共45分)
1.(2002年全国高考题)常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中
A.c(HCOO-)>c(Na+)
B.c(HCOO-)<c(Na+)
C.c(HCOO-)=c(Na+)
D.无法确定c(HCOO-)与c(Na+)的关系
2.(2002年上海高考题)在常温下10 mL pH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A.c(A-)=c(K+)
B.c(H+)=c(OH-)<c(K+)<c(A-)
C.V后≥20 mL
D.V后≤20 mL
3.物质的量浓度相同(0.1 mol·L-1)的弱酸HX与NaX溶液等体积混合后,溶液中粒子浓度关系错误的是
A.c(Na+)+c(H+)=c(X-)+c(OH-)
B.若混合液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
C.c(HX)+c(X-)=2c(Na+)
D.若混合液呈碱性,则c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
4.将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合后溶液中
c(Na+)>c(X-),则下列关系正确的是
A.c(OH-)<c(H+)
B.c(HX)<c(X-)
C.c(X-)+c(HX)=2c(Na+)
D.c(HX)+c(H+)=c(Na+)+c(OH-)
5.某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关的叙述正确的是
A.H2Y的电离方程式为:H2Y+H2O![]() H3O++HY-
H3O++HY-
B.在该酸式盐溶液中c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C.HY-的水解方程式为HY-+H2O![]() H3O++Y2-
H3O++Y2-
D.在该酸式盐溶液中c(Na+)>c(HY-)>c(OH-)>c(H+)
6.将0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后,溶液显酸性,则溶液中有关粒子的浓度关系正确的是
A.c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
B.c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.c(CH3COO-)=c(Cl-)>c(H+)>c(CH3COOH)
D.c(Na+)+c(H+)>c(CH3COO-)+c(Cl-)+c(OH-)
7.物质的量浓度相同的下列溶液中,NH![]() 浓度最大的是
浓度最大的是
A.NH4NO3 B.NH4HSO4
C.CH3COONH4 D.NH4HCO3
8.CH3COOH与CH3COONa以等物质的量混合配制成的稀溶液,pH为4.7,下列说法错误的是
A.CH3COOH的电离作用大于CH3COONa的水解作用
B.CH3COONa的水解作用大于CH3COOH的电离作用
C.CH3COOH的存在抑制了CH3COONa的水解
D.CH3COONa的存在抑制了CH3COOH的电离
9.已知0.1 mol·L-1的NaHCO3溶液的pH=8,同浓度的NaAlO2溶液的pH=11,将两种溶液等体积混合,并且发生了反应,可能较大量生成的物质是
A.CO2 B.Al(OH)3
C.CO![]() D.Al3+
D.Al3+
二、非选择题(共55分)
10.(12分)(1)碳酸钾的水溶液蒸干得到的固体物质是 ,原因是 。
(2)KAl(SO4)2溶液蒸干得到的固体物质是 ,原因是 。
(3)碳酸氢钡溶液蒸干得到的固体物质是 ,原因是 。
(4)亚硫酸钠溶液蒸干得到的固体物质是 ,原因是 。
(5)氯化铝溶液蒸干得到的固体物质是 ,原因是 。
(6)盐酸与硫酸浓度各为1 mol·L-1的混合酸10 mL,加热浓缩至1 mL,最后得到的溶液是 ,原因是 。
11.(12分)用离子方程式表示下列反应:
(1)某可溶性盐的化学式XmYn(是最简结构m≠n),将一定量的该盐溶于足量的水中,若测得溶液的pH为3,该盐水解的离子方程式可能为 。若测得溶液的pH为11,则该盐与水反应的离子方程式可能为 。
(2)NH4Cl溶液与Na反应 。
(3)AlCl3溶液与NaAlO2溶液反应 。
(4)CuSO4溶液与Na2S溶液反应 。
(5)NaHSO4溶液与NaHCO3溶液反应 。
(6)FeCl3溶液与NaI溶液反应 。
12.(10分)25℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ;
② ;
③ 。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01 mol·L-1的是 ,浓度为0.002 mol·L-1的是 。
(4) 和 两种粒子物质的量之和等于0.01 mol。
(5) 和 两种粒子物质的量之和比氢离子数量多0.008 mol。
13.(9分)某试剂厂用银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银,步骤如下:
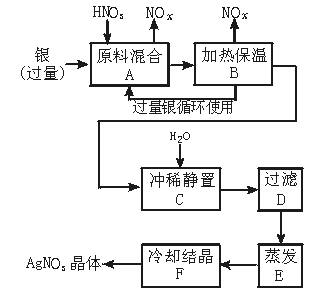
依据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用 硝酸(填“浓”或“稀”),原因是 。
a.减少过程中产生NOx的量
b.减少原料银的消耗量
c.节省硝酸物质的量
(2)步骤B加热保温的作用是 。
a.有利于加快反应速率
b.有利于未反应的硝酸挥发
c.有利于硝酸充分反应,降低溶液中c(H+)
(3)步骤C是为了除去Fe3+、Cu2+等杂质。冲稀静置时发生的化学反应是 。
a.置换反应
b.水解反应
c.氧化还原反应
产生的沉淀物化学式是 。
14.(6分)某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液的等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液的等体积混合液
据此,填写下列空白(填代号):
(1)c(H+)最大的是 ,最小的是 。
(2)c(H2A)最大的是 ,最小的是 。
(3)c(A2-)最大的是 ,最小的是 。
15.(6分)已知(1)Cu2+、Fe2+在pH为 4~5的条件下不水解,而这一条件下Fe3+几乎全部水解。
(2)双氧水(H2O2)是强氧化剂,在酸性条件下,它的还原产物是H2O。
现用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液的过程如下:
①取50 mL纯净的盐酸,加入一定量的粗CuO加热搅拌、充分反应后过滤,测知滤液的pH=3。
②向滤液中加入双氧水、搅拌。
③调节②中溶液的pH至4,过滤。
④把③所得滤液浓缩。
回答以下问题:
(1)②中发生反应的离子方程式是 。
(2)③中使pH升高到4,采取的措施是:加入过量的 并微热、搅拌。
A.NaOH B.氨水
C.CuCl2 D.CuO
(3)③中过滤后滤渣的成分是 。
高考能力测试步步高化学基础训练28答案
一、1.C 2.AD 3.D 4.C 5.AD 6.B 7.B 8.BD 9.BC
二、10.(1)K2CO3 尽管加热过程促进了K2CO3的水解,但生成的KHCO3和KOH反应后仍为K2CO3
(2)明矾 尽管Al3+水解,因H2SO4为高沸点酸,最后仍得结晶水合物明矾
(3)BaCO3 Ba(HCO3)2在溶液中受热就会分解,而得到BaCO3
(4)Na2SO4 Na2SO3在蒸干的过程中不断被空气氧化而变成Na2SO4
(5)Al(OH)3和Al2O3 AlCl3水解生成Al(OH)3和HCl,由于HCl挥发,促进了水解,得到Al(OH)3,Al(OH)3部分分解得Al2O3
(6)10 mol·L-1 H2SO4溶液 蒸发浓缩过程中HCl挥发,最后剩余为较浓H2SO4溶液
11.(1)Xn++nH2O![]() X(OH)n+nH+
X(OH)n+nH+
Ym-+H2O![]() HY(m-1)-+OH-
HY(m-1)-+OH-
(提示:多元弱酸根水解,以第一步为主,故Ym-水解第一步只能得到HY(m-1)-,而不能写成HmY)
(2)2NH![]() +2Na===2Na++2NH3↑+H2↑
+2Na===2Na++2NH3↑+H2↑
(3)Al3++3AlO![]() +6H2O===4Al(OH)3↓
+6H2O===4Al(OH)3↓
(4)Cu2++S2-===CuS↓
(5)HCO![]() +H+===H2O+CO2↑
+H+===H2O+CO2↑
(6)2Fe3++2I-===2Fe2++I2
12.(1)①CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
②CH3COOH![]() CH3COO-+H+
CH3COO-+H+
③H2O![]() H++OH-
H++OH-
(2)7 (3)Na+ Cl- (4)CH3COOH CH3COO-
(5)CH3COO- OH-
13.(1)稀 ac (2)ac (3)b Fe(OH)3、Cu(OH)2
14.(1)A D (2)C D (3)D A
15.(1)2Fe2++H2O2+2H+===2Fe3++2H2O
(2)D
(3)Fe(OH)3、CuO