高考总复习化学单元测试卷(一)
(满分100分,考试时间90分钟) 命题:张明昭
说明:本试卷分第Ⅰ卷和第Ⅱ卷两部分;第Ⅰ卷为选择题,答题时请将答案的序号(A、B、C、D)填写在第Ⅱ卷卷首的答案栏内;第Ⅱ卷为非选择题,答题时请将答案直接填写在该题的空白处。
第Ⅰ卷
一、选择题(本题包括20小题,每小题3分,共60分。每小题均只有一个选项符合题意。)
1、区别强弱电解质的依据是( )
A、化合物的导电能力 B、在水中的溶解度
C、化合物在溶液中的离解程度 D、物质的质量
2、下列离子方程式中,正确的是( )
A、Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++HCO3-+OH -=CaCO3↓ +H2O
B、NaHSO4溶液与过量Ba(HCO3)2溶液反应:
2H++SO42-+Ba2++2HCO3-=BaSO4 ↓+2CO2↑+2H2O
C、FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl -
D、Ba(OH)2溶液加入NaHSO4溶液至中性:Ba2++2OH- +2H ++SO42-=BaSO4↓+2H2O
3、彩电荧光屏中的蓝色荧光粉是掺有约0.0001%氯化银的ZnS晶体。某学生对此晶体进行分析,如果要使ZnS溶解且保证氯化银溶解的量尽可能少(25℃时,氯化银在水中溶解度为![]() ),以下试剂中最适宜的是(
)
),以下试剂中最适宜的是(
)
A、稀硫酸 B、盐酸 C、硝酸 D、![]()
4、设NA代表阿佛加德常数,下列说法正确的是( )
A、23克金属钠变为钠离子时失去的电子数为NA
B、18克水所含的电子数目为NA
C、在常温常压下11.2升氯气所含的原子数目为NA
D、32克氧气所含的原子数目为NA
5、设NA为阿佛加德罗常数,200毫升Ba(NO3)2溶液中含Ba2+和NO3-总数为0.45NA,则该溶液的摩尔浓度为 ( )
A、2.25摩/升 B、0.75摩/升
C、1.5摩/升 D、6.75摩/升
6、三个容器中分别盛有H2、CH4、O2,已知三个容器中气体的温度、密度都相等,下列说法正确的是 ( )
A、三种气体质量相等
B、三种气体的物质量之比依次为16:2:1
C、三种气体压强比为16:2:1
D、三种气体体积比为1:8:16
7、完全燃烧10毫升H2和CO组成的混和气体,需同温同压下的氧气的体积为( )
A、2.5毫升 B、5毫升
C、15毫升 D、无法确定
8、两气体A和B的摩尔质量之比为2:1,则它们在同温、同压、同体积时的分子个数比应为 ( )
A、1:1 B、1:2 C、2:1 D、4:1
9、下列物质转化需要加入还原剂才能实现的是( )
A、SO32- →SO2 B、HCl→Cl2
C、Na →Na+ D、SO2→S
10、在下列氧化还原反应中,溴单质既做氧化剂又做还原剂的是( )
A、Br2+3F2=2BrF3
B、2P+6H2O+3Br2=2H3PO4+6HBr↑
C、3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑
D、SO2+2H2O+Br2=H2SO4+2HBr
11、某金属硝酸盐受热分解时,生成NO2和O2的物质的量之比为2:1,则在分解过程中该金属元素的化合价将( )
A、升高 B、降低 C、不变 D、无法确定
12、在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,被氧化与被还原的硫原子数之比为( )
A、1 :1 B、2 :1 C、1 :2 D、3 :2
13、硫代硫酸钠可作为脱氯剂,已知25.0mL 0.100 mol·L-1 Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成( )
A、S2- B、S C、SO32- D、SO42-
14、已知下列三个反应:
2Fe2++Cl2 == 2Fe3++2Cl-
2Fe3++Cu
== 2Fe2++Cu2+
Fe+Cu2+
== Fe2++Cu
试推断结论:
具有还原性物质的还原性强弱:
①Fe>Cu>Fe2+>Cl- ②Cl->Fe2+>Fe>Cu
具有氧化性物质的氧化性强弱:
③Fe3+>Cl2>Fe2+>Cu2+ ④Cl2>Fe3+>Cu2+>Fe2+
其中结论正确的是 ( )
A、①③ B、②③ C、①④ D、②④
15、两份铝,一份加入强碱液,一份加入盐酸中,假设酸碱过量,要使前后反应收集到的氢气质量之比为1:2,则两份铝的质量比为 ( )
A、1:2 B、2:1 C、1:4 D、1:1
16、有a、b、c、d、e五种物质,它们是硫及其化合物,已知在一定条件下有如下转化关系(未配平):
![]()
则这些物质中硫元素的化合价或平均化合价由低到高的顺序是( )
A、a、b、c、d、e B、d、c、a、b、e
C、e、b、a、c、d D、b、a、c、e、d
17、某温度下,将![]() 通入
通入![]() 溶液中,反应得到
溶液中,反应得到![]() 的混合液,经测定
的混合液,经测定![]() 的浓度之比为1:3,则
的浓度之比为1:3,则![]() 溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为( )
溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为( )
A、21:5 B、11:3 C、3:1 D、4:1
18、炽热的炉膛内有反应:C(固)+O2(气)=CO2(气) ; △H=-392KJ·mol-1
往炉膛内通入水蒸气时,有如下反应:
C(固)+H2O(气)=CO(气)+H2(气) ; △H=+131KJ·mol-1
CO(气)+![]() O2(气)=CO2(气) ; △H=-282KJ·mol-1
O2(气)=CO2(气) ; △H=-282KJ·mol-1
H2(气)+ ![]() O2(气)=H2O(气) ; △H=-241KJ·mol-1
O2(气)=H2O(气) ; △H=-241KJ·mol-1
由以上反应推断往炽热的炉膛内通入水蒸气时 ( )
A、不能节省燃料,但能使炉火瞬间更旺
B、虽不能使炉火更旺,但可以节省燃料
C、既能使炉火更旺,又能节省燃料
D、既不能使炉火更旺,又不能节省燃料
19、直接测定同素异形体相互转化的反应热是很困难的。盖斯定律指出:“不管化学过程是一步完成还是分几步完成,其总过程的热效应是相同的”。已知:
P4(固、白磷)+5O2(气) == P4O10(固) ;
△H=-2983.2KJ·mol-1
P(固、红磷)+![]() O2(气) ==
O2(气) == ![]() P4O10(固) ;
△H=-738.5KJ·mol-1
P4O10(固) ;
△H=-738.5KJ·mol-1
那么,1摩白磷转变成相应物质量的红磷时,应是 ( )
A、放出29.2KJ热量 B、吸收29.2KJ热量
C、放出2244.7KJ热量 D、吸收2244.7KJ热量
20、将NaCl和NaBr的混和物m克溶于足量的水配成500毫升的溶液A,再向其中通入足量的氯气,充分反应后蒸发至干,得干燥晶体(m-2)克,则A溶液中Na+、Br-、Cl-的物质的量浓度之比不可能为( )
A、3:2:1 B、3:1:2 C、4:3:1 D、3:1:4
福建仙游私立一中高考总复习
化学单元测试卷(一)
(满分100分,考试时间90分钟) 命题:张明昭
| 题 号 | 一 | 二 | 三 | 四 | 五 | 总 分 |
| 得 分 |
|
|
|
|
|
|
第Ⅰ卷(选择题,共60分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|
|
|
|
|
|
|
|
|
|
|
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷 ( 非选择题,共40分)
二、填空题:(本题共22分。)
21、(6分)火力发电厂燃烧煤的废气中往往含有有害气体SO2,为了变废为宝,常常用粉未状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏,请回答:
(1)写出上述两个的反应的化学方程式:
(2)试说明用熟石灰的悬浊液,而不用澄清石灰水洗涤废气的理由
22、(4分)(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:
23.(12分)用Cl2消毒饮用水已有百年历史,近年发现这种方法可能对人体有害。世界环保联盟推荐采用广谱高效消毒剂ClO2。ClO2是黄绿色易爆物,沸点9.90℃。制备ClO2的方法之一表述为:
![]() KClO3+ HCl(浓)
KCl + ClO2↑+ Cl2↑+
KClO3+ HCl(浓)
KCl + ClO2↑+ Cl2↑+
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)
(2)盐酸在反应中显示出来的性质是_______(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量为_________mol.
(4)用此法制备获得的ClO2和其它生成物分离的方法是 ;
(5)与传统消毒剂Cl2比较,ClO2消毒的效率(以单位质量得到的电子数表示)是Cl2的_______倍。
 三、实验题:(本题共10分。)
三、实验题:(本题共10分。)
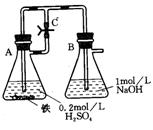
24、在右图的装置中,当容器A中的反应开始后,再分别进行下列操作:
(1)若弹簧夹C打开,B容器中有何现象?
(2)若弹簧夹C关闭一会儿,容器A中的反应还在进行时,B容器中有何现象?
其反应的化学方程式为
(3)若先打开弹簧夹C一段时间,容器A中的反应还在进行时,再关闭弹簧C一会儿,B容器中有何现象?
四、计算题:(本题共8分。)
25、向8g二价金属的氧化物固体中加入稀硫酸,使其恰好完全溶解,己知所消耗的硫酸体积为100mL ,在所得溶液中插入铂电极进行电解,通电一段时间后,在一个电极上收集到224mL (标准状况)氧气,在另一个电极上析出金属1.28g。
(1) 根据计算确定金属氧化物的名称。
(2) 计算通电后硫酸溶液的物质的量浓度(液体体积按100mL 计算)。
五.附加题:(本题另加10分。)
26.某天然碱(纯净物)可看作由CO2和NaOH反应后的产物所组成。称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生CO2的体积(标准状况)如下表:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| 盐酸液的体积(mL) | 30 | 30 | 30 | 30 |
| 样品(g) | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积(mL) | 672 | 840 | 896 | 672 |
(1) 推测用2.49g样品进行同样的实验时,产生CO2_________mL(标准状况)。
(2)另取3.32g天然碱样品于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式。
(3)已知Na2CO3和HCl(aq)的反应分下列两步进行:
Na2CO3+HCl → NaCl+NaHCO3
Na2CO3+HCl → NaCl+CO2↑+H2O
所用的HCl(aq)的浓度为 mol/L
(4)依据上表所列数据以及天然碱的化学式,讨论并确定上述实验中CO2(标准状况)体积V(mL)与样品质量W(g)之间的关系式。
参考答案:
第Ⅰ卷(选择题,共60分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
C | D | B | A | B | C | B | A | D | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | C | D | C | A | C | D | A | A | D |
21、(1)①2SO2+2CaCO3+O2+4H2O == 2CaSO4·2H2O+2CO2(2分)
②2SO2+2Ca(OH)2+O2+2H2O == 2CaSO4·2H2O(2分)
注:将产物写成CaSO4者给1分,未配平者不给分。
(2)澄清石灰水中所含的Ca(OH)2的量较少,不利于废气的吸收。
22、(1)2HSO4-+Ba2++2OH- == 2H2O+BaSO4¯+SO42-
(或2H++SO42-+Ba2++2OH- == 2H2O+BaSO4¯)(2分)
(2)SO42-+Ba2+ == H2O+BaSO4¯(2分)
23. (1)2,4,2,2,1,![]() (3分)
(3分)
注:写出H2O而未配平者给1分。
(2)② (2分)
(3)0.2 (2分)
(4)冷凝 (2分)
(5)2.63倍。(3分)
24、(1)容器B中的导管口有气泡冒出(1分)
(2)A容器的溶液流入B容器中,开始生成白色沉淀迅速变成灰绿色,最终变成红褐色(2分)
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4(2分)
4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分)
(3)打开弹簧夹C,容器B中的导管口有气泡冒出;(1分)弹簧夹C关闭容器A中溶液进入B容器中,有白色沉淀生成。(2分)
25、(1)设该金属为M,由电子守衡可知:
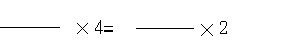 0.224
1.28
0.224
1.28
22.4 M
解得:M=64
∴金属氧化物为氧化铜(4分)
注:解法正确而未写出名称者扣1分。
(2)0.2mol/L(4分)
26.(本题共10分)(1) 由第Ⅰ组数据(或第Ⅱ组数据)推测: 504 (2分)
(2)由题意可知,天然碱含NaHCO3、Na2CO3
n(NaHCO3)=2n(CO2)=2×![]()
n(Na2CO3)=![]()
n(H2O)=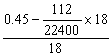 =0.02(mol)
=0.02(mol)
∴天然碱组成:2Na2CO3·NaHCO3·2H2O (3分)
(3) (由上表中第Ⅳ组数据可以确定)2.5 (2分)
注:30mL HCl(aq)中所含HCl物质的量:
n(HCl)=![]()
![]()
(4)求界点:和30mL HCl(aq)完全反应的样品的质量:
![]()
样品中Na2CO3和盐酸反应完全生成NaHCO3时(没有CO2放出时),样品质量:
![]()
答案:0<W≤4.98 V(CO2)=202.4W(mL)
注 V(CO2)=![]() (1分)
(1分)
4.98≤W≤12.45 V(CO2)=1680-134.9W(mL)
注:V(CO2)=[0.075-![]() ]×22400(mL)也给分
(1分)
]×22400(mL)也给分
(1分)
12.45≤W V(CO2)=0 (1分)