高考化学模拟试卷十三
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,共150分。考试时间120分钟。答题时,请将第I卷每小题答案选出后,填在第5页答卷表格的对应空格中,若仅答在题纸上则不给分。将第II卷各题的答案直接答在试卷的相应位置上。
可能用到的原子量:H 1 C12 N 14 O16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Fe 56 Cu 64 Zn 65
第I卷(选择题共83分)
一、 选择题(本题包括5小题,每小题3分,共15分。每小题只有一个选项符合题意。)
1、 1993年的世界10大科技新闻称,中国学者徐志傅和美国科学家穆尔共同合成了世界上最大的碳氢分子,其中一个分子由1134个碳原子和1146个氢原子构成。关于此物质,下列说法错误的是
(A)是烃类化合物 (B)常温下呈固态 (C)具有类似金刚石的硬度 (D)能在空气中燃烧
2、
氯仿(CHCl![]() )可用作麻醉剂,常因保存不慎而被空气氧化产生剧毒物(CHCl
)可用作麻醉剂,常因保存不慎而被空气氧化产生剧毒物(CHCl![]() )(光气)和氯化氢,为了防止事故发生,在使用前要检查氯仿是否变质,应选用的检查试剂是
)(光气)和氯化氢,为了防止事故发生,在使用前要检查氯仿是否变质,应选用的检查试剂是
(A)H![]() O (B)AgNO
O (B)AgNO![]() 溶液 (C)NaOH溶液 (D)KI溶液
溶液 (C)NaOH溶液 (D)KI溶液
3、向某无色溶液中逐滴加入稀氨水,开始产生沉淀,继续滴加时沉淀逐渐消失,仍得无色溶液。则原溶液可能是
(A)AlCl![]() 溶液 (B)AgNO
溶液 (B)AgNO![]() 溶液 (C)NaAlO
溶液 (C)NaAlO![]() 溶液 (D)Ba Cl
溶液 (D)Ba Cl![]() 溶液
溶液
4、下列各组物质的沸点,前者高于后者的是
(A)干冰、二氧化硅 (B)新戊烷、正戊烷 (C)金属汞、金属银 (D)乙醛、甲醛
5、某同学用托盘天平称量固体药品时,称量前指针未调零点,称量时样品放置天平的左盘。天平平衡时用了10g砝码,游码指示0.5g,则药品的真实质量是
(A)>10.5g (B)<10.5g (C)=10.5g (D)无法确定
二、 选择题(本题包括12小题,每小题3分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给一分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
6、
钡和钠相似,也能形成含O![]()
![]() 离子的过氧化物,下列叙述中正确的是(A)过氧化钡Ba
离子的过氧化物,下列叙述中正确的是(A)过氧化钡Ba![]() O
O![]() 的化学式是 (B)1mol过氧化钠或过氧化钡跟足量水反应都生成0.5mol氧气 (C)O
的化学式是 (B)1mol过氧化钠或过氧化钡跟足量水反应都生成0.5mol氧气 (C)O![]()
![]() 离子的电子式为
离子的电子式为 ![]() (D)过氧化钠或过氧化钡都是强氧化剂
(D)过氧化钠或过氧化钡都是强氧化剂
7、 有下列两种假设:(1)一种碱溶液与一种盐溶液混合反应后,生成一种强碱性性物质;(2)两种酸溶液混合反应后,溶液的酸性减弱。其中确有具体例证存在的是(A)只有(1) (B)只有(2) (C)(1)和(2) (D)都不存在
8、 限用一种试剂,不可能鉴别出来的是
|
|
(A)FeS、CuO、MnO![]() 三种固体 (B)NHCO
三种固体 (B)NHCO![]() 、KNO
、KNO![]() 三种溶液 (C)苯、己烯、甲苯三种液体 (D)NH
三种溶液 (C)苯、己烯、甲苯三种液体 (D)NH![]() Cl、MgCl
Cl、MgCl![]() 、Na
、Na![]() CO
CO![]() 三种溶液
三种溶液
9、
最近医学界通过用放射性![]() 标记的
标记的![]() ,发现一种的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS),则有关
,发现一种的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS),则有关![]() 的叙述正确的是
的叙述正确的是
(A)与![]() 中普通碳原子的化学性质不同 (B)与
中普通碳原子的化学性质不同 (B)与![]() 含的中子数相同 (C)是
含的中子数相同 (C)是![]() 的同素异形体 (D)与
的同素异形体 (D)与![]() 互为同位素
互为同位素
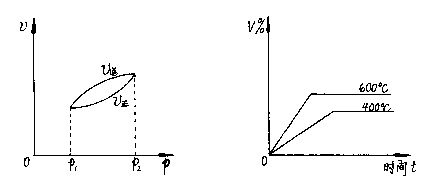 |
10、同时符合下列两个图象的反应(v表示反应速率,V%表示某气态生成物的体积分数,Q>0)是
(A)![]()
(B)![]()
(C)![]()
(D)![]()
11、向一容积为5L的恒容密闭容器中,充入5molA与8molB,在一定条件下发生反应:2A(气)+3B(气)![]() xC(气)+yD(气)(x,y均为正整数)。反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol
xC(气)+yD(气)(x,y均为正整数)。反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol![]() ,D的平衡浓度为0.3mol
,D的平衡浓度为0.3mol![]() ,又知v(B):v(C)=3:2,则下列说法中一定不正确的是
,又知v(B):v(C)=3:2,则下列说法中一定不正确的是
(A)x:y=2:1 (B) v(A):v(C)= 2:1 (C)A的平衡浓度为0.4 mol![]() (D)A与B的平衡浓度之比为2:3
(D)A与B的平衡浓度之比为2:3
12、在常温下,相同pH的![]() 和
和![]() 溶液中,由水电离出的
溶液中,由水电离出的![]() 分别是
分别是![]() 和
和![]() ,水的电离度分别是
,水的电离度分别是![]() 和
和![]() ,下列关系式错误的是 (A)
,下列关系式错误的是 (A) ![]() <
<![]() (B) a>b
(C)a<b
(D)
(B) a>b
(C)a<b
(D) ![]() =
=![]()
13、某学生用下列溶质配制一种混合液,已知溶液中![]() ,则其溶质可能为(A)KCl、
,则其溶质可能为(A)KCl、![]() (B)NaCl、
(B)NaCl、![]() (C)NaCl、
(C)NaCl、![]() 、
、![]() (D)KCl、
(D)KCl、![]() 、
、![]()
14、含溶质的质量分数相同的浓氨水(密度![]() )和浓NaOH溶液(
)和浓NaOH溶液(![]() ),各取5mL,分别与等体积水混合,所得稀氨水质量分数为a%,稀NaOH溶液的质量分数为b%,则a与b的关系正确的是(A) a>b (B)b>a (C)a=b(D)不能确定
),各取5mL,分别与等体积水混合,所得稀氨水质量分数为a%,稀NaOH溶液的质量分数为b%,则a与b的关系正确的是(A) a>b (B)b>a (C)a=b(D)不能确定
15、通常情况下,下列物质能大量共存的是
(A)H![]() S、Cl
S、Cl![]() SO
SO![]()
![]()
![]() (B)H
(B)H![]() O
O![]() CH
CH![]() =CH
=CH![]() (C) 溶液中
(C) 溶液中![]() (D) 溶液中
(D) 溶液中![]()
16、下列离子方程式错误的是
(A)向偏铝酸钠溶液中滴加少量盐酸:![]()
(B) 实验室制取氯气:![]()
(C)向三氯化铁溶液中加入过量铜屑:![]()
(D)
用NaOH溶液吸收少量![]() 气体:
气体:![]()
17、下图两个装置中,溶液体积均为100mL,开始时电解质溶液的浓度均为![]() 。工作一段时间后,测得导线上通过0.02mol电子。若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是
。工作一段时间后,测得导线上通过0.02mol电子。若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是
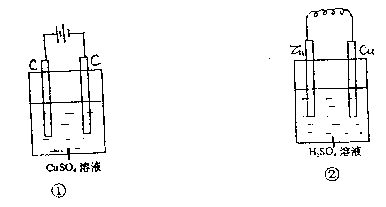 |
(A)产生气体的体积:①>②
(B) 电极上析出固体的质量:①>②
(C)溶液pH的变化:①减小;②增大
(D)
电极反应式:①中阳极![]() ;②中负极
;②中负极![]()
三、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
18、有含C、H、O三种元素的有机物完全燃烧时生成的![]() 与消耗O
与消耗O![]() 的物质的量之比为4:5,并知分子中氧原子与氢原子的物质的量之比小于1:2,则该有机物可能是
的物质的量之比为4:5,并知分子中氧原子与氢原子的物质的量之比小于1:2,则该有机物可能是
(A)![]() (B)
(B) ![]() (C)
(C) ![]() (D) HCHO
(D) HCHO
19、某种干燥粉末混合物可能由![]() 中的两种或几种组成(假设固体混合时不反应)。若将其先与足量盐酸反应则逸出气体a,当a缓慢通过足量的NaOH溶液时气体体积缩小(同温、同压),但仍有剩余。另取原混合物在空气中加热至气体不再发生,发现剩余固体的质量增加,则对原混合物的叙述正确的是
中的两种或几种组成(假设固体混合时不反应)。若将其先与足量盐酸反应则逸出气体a,当a缓慢通过足量的NaOH溶液时气体体积缩小(同温、同压),但仍有剩余。另取原混合物在空气中加热至气体不再发生,发现剩余固体的质量增加,则对原混合物的叙述正确的是
(A)一定含有![]() (B) 一定含有
(B) 一定含有![]() 和NaCl (C)不含有
和NaCl (C)不含有![]() (D) 不含有
(D) 不含有![]()
20、将一定量的铁粉和硫粉的混合物共热,充分反应后冷却,再加入足量稀![]() ,得到标准状况下的气体11.2L,则原混合物可能的组成是(n代表物质的量)
,得到标准状况下的气体11.2L,则原混合物可能的组成是(n代表物质的量)
(A)n(Fe)<n(S),总质量等于44g
(B)n(Fe)>n(S),总质量等于44g
(C)n(Fe)=n(S),总质量大于44g
(D)n(Fe)>n(S),总质量小于44g
21、某温度时![]() 的溶解度是25g,若温度不变,将32g无水
的溶解度是25g,若温度不变,将32g无水![]() 粉末撒入mg水中,形成饱和溶液并有
粉末撒入mg水中,形成饱和溶液并有![]()
![]() 晶体析出时,则m的取值范围是
晶体析出时,则m的取值范围是
(A)18g![]() (B)36g<m<180g
(C)18g<m<128g
(D)36g
(B)36g<m<180g
(C)18g<m<128g
(D)36g![]()
22、在相同条件下,把Zn ,Fe ,Al分别投入到质量相等的足量稀![]() 中,反应结束后三种溶液的质量仍相等,则投入的Zn ,Fe ,Al三种金属的质量关系是
中,反应结束后三种溶液的质量仍相等,则投入的Zn ,Fe ,Al三种金属的质量关系是
(A)Al>Fe>Zn (B)Fe>Al>Zn (C)Al>Zn>Fe (D) Zn>Fe>Al
23、工业废气中的氮氧化合物是主要的大气污染源之一,为了保护环境,工业上常通入氨与之发生如下反应:![]() ,使之转化为无毒的
,使之转化为无毒的![]() 。现有NO
。现有NO![]() 和NO的混合气体3L,通入3L(同温、同压下)恰好使其完全转化为
和NO的混合气体3L,通入3L(同温、同压下)恰好使其完全转化为![]() 。原混合气体中NO
。原混合气体中NO![]() 和NO的物质的量之比为 (A)1:1 (B)2:1 (C)3:1 (D)1:4
和NO的物质的量之比为 (A)1:1 (B)2:1 (C)3:1 (D)1:4
24、为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确,且最后能得到纯物质的是
| 选项 | 被提纯的物质 | 除杂试剂 | 分离办法 |
| (A) | 溴化钠溶液 (碘化钠) | 氯水、四氯化碳 | 萃取、分液 |
| (B) | 氯化铵溶液 (氯化铁) | 氢氧化钠溶液 | 过滤 |
| (C) | 二氧化碳 (一氧化碳) | 氧化铜粉末 | 通过灼热氧化铜粉末 |
| (D) | 苯 (苯酚) | 浓溴水 | 过滤 |
25、已知氮的氧化物跟溶液发生的化学反应如下:
![]()
![]()
现有m mol
NO![]() 和n mol NO组成的混合气体,要用NaOH溶液使其完全吸收无气体剩余,现有浓度为a mol
和n mol NO组成的混合气体,要用NaOH溶液使其完全吸收无气体剩余,现有浓度为a mol![]() 的NaOH溶液,则需此NaOH溶液的体积是
的NaOH溶液,则需此NaOH溶液的体积是
(A)![]() (B)
(B)![]() (C)
(C)![]() (D)
(D)![]()
第II卷(非选择题,共67分)
四、(本题包括2小题,共17分)
26、A、B、C是中学化学实验中常见的几种使用分液漏斗的装置图。
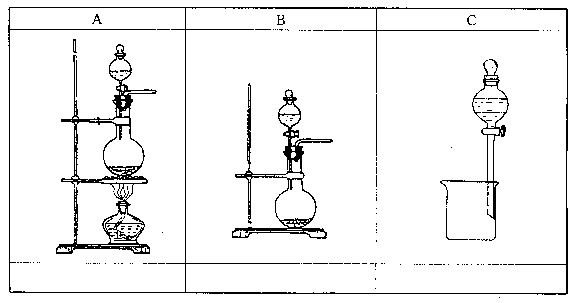
(1)请从[1]~[10]中选出必须使用分液漏斗的实验,把编号填入最适宜的装置图A~C下面和空格中(多选要倒扣分):
[1]酒精和浓硫酸混合加热制乙烯 [2]浓盐酸和二氧化锰混合加热制氯气
[3]分离苯和硝基苯的混合物 [4]用氯化钠和浓硫酸加热制邓氯化氢
[5]浓硫酸跟亚硫酸钠制二氧化硫 [6]用浓硝酸跟铜反应制二氧化氮
[7]用饱和亚硝酸钠溶液跟饱和氯化铵溶液共热制氮气[8]用电石跟水反应制乙炔
[9]分离乙酸和乙醇的混合物 [10]从溴水中用苯提取溴单质
(2)上述装置中,真正起到分液作用的是——-(填A或B或C)。可应用于两种——物质的分离。
27、下面是四种盐在不同温度下的溶解度(g/100g H![]() O)
O)
| 温度 |
|
| N |
|
| 10 | 80.5 | 20.9 | 35.7 | 31.0 |
| 100 | 175 | 246 | 39.1 | 56.6 |
(假设:[1]盐类共存时不影响各自的溶解度。[2]分离晶体时,溶剂的损耗忽略不计。)
某同学设计用物质的量比为1:1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如图:
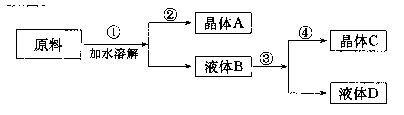
(1)在[1]和[3]的实验过程中,关键的实验条件是——。
(2)分离出晶体的[2]和[4]的操作是——————(填倾倒、蒸发、结晶、过滤中的某种操作)。硝酸钾晶体————-(A或C)。
(3)粗产品中可能含有的杂质离子是————;检验的方法是————————。
(4)欲将粗产品提纯,可采取的方法是————。
五、(本题包括3小题,共17分)
28、在一烧杯中盛有100mL mol![]() 的
的![]() 溶液,同时有一表面光滑的塑料小球悬浮于溶液中央(如右图所示)。向该烧杯里缓缓注入0.4 mol
溶液,同时有一表面光滑的塑料小球悬浮于溶液中央(如右图所示)。向该烧杯里缓缓注入0.4 mol![]() 的
的![]() 溶液至恰好完全反应,在此实验过程中
溶液至恰好完全反应,在此实验过程中
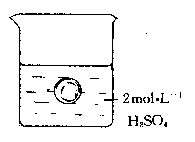
(1)烧杯里观察到的实验现象有:
[1]——————————————;
[2]——————————————。
(2)写出实验过程中反应的离子方程式——————————。
29、氮、磷、钾是植物生长的重要营养元素,洗衣粉中如加入由磷酸脱水制得的多磷酸的钠盐作配料,能起软化水的作用。但作用此类洗衣粉会造成水质污染,试简述污染水质的原因————————————;某种无磷洗衣粉中加入了硅酸钠作配料,试说明这种配料的有关性质与作用——————————————。
30、下图是中学化学中常见的物质间化学反应关系的图示,其中A的焰色反应呈黄色,E、F为有刺激性气味的气体,G为强酸性溶液,H为既难溶于水、也难溶于稀酸的白色固体。
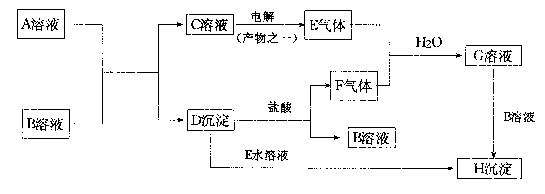
试回答:
(1)写出化学式:A——;B——。
(2)写出下列反应的离子方程式:
[1]C![]() :——
:——
[2]![]() :——
:——
[3]![]() :——
:——
六、(本题包括3 小题,共18分)
31、合成类固醇是奥委会医学委员会于1984年公布的违禁药物之一。从结构上看,类固醇是一类含有环戊烷多氢菲核(如I式)基本结构的化合物。这种药物之一的17![]() 烷基化睾酮衍生物如康力龙(其结构简式如II式),由于其分子中17
烷基化睾酮衍生物如康力龙(其结构简式如II式),由于其分子中17![]() 烷基的作用,此种药物具有对肝功能明显的损害作用,过量作用还会产生女子男性化,男子过早秃顶,肝中毒甚至肝癌等毒副作用,因此属违禁药物。
烷基的作用,此种药物具有对肝功能明显的损害作用,过量作用还会产生女子男性化,男子过早秃顶,肝中毒甚至肝癌等毒副作用,因此属违禁药物。
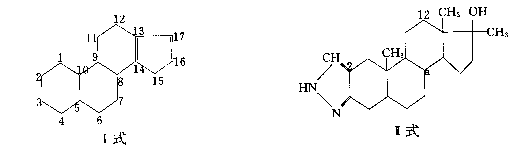 |
(1)康力龙分子中共有——个碳原子。
(2)用I式中给碳位编号的方法给II式碳原子定位其中a位的编号是——。
(3)已知I式能使溴水褪色,将其可能产物的结构简式填入下列空白(未参加反应部位的碳环可略去不写,但反应部位的碳环上碳位编号至少要标上两处,可不填满,也可补充,有几个填几个。):
[1] -----------[2]----------[3]------------[4]----------[5]-----------[6]------------。

32、已知烯烃的同分异构体除存在双键的位置异构外,还有顺反异构,产生顺反异构的条件必须是双键两端的碳原子上连有不同的原子或原子团。如
(a,b为不同的原子或原子团)
已知某有机物A的结构简式为
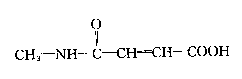
,它在一定条件下能发生与多肽水解类似的水解反应。
(1)写出A的顺式结构的结构简式:————。
(2)写出A在一定条件下水解的化学方程式:——————。
(3)写出与A分子式相同的,分子中有
的![]() 氨基酸的结构简式:--------------------。
氨基酸的结构简式:--------------------。
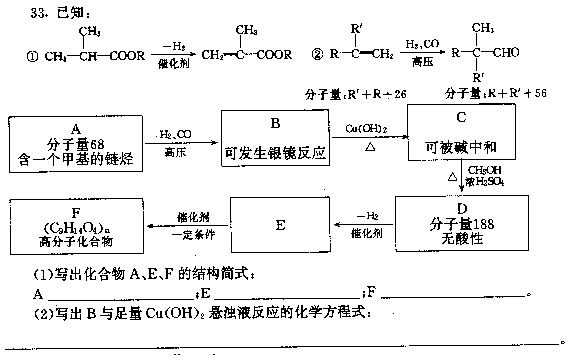
七、(本题包括2小题,共15分)
34、在2.00L含![]() 的混合液中,加入33.6g铁粉,充分反应后过滤,可得29.6g沉淀。此时溶液中只含0.50mol的
的混合液中,加入33.6g铁粉,充分反应后过滤,可得29.6g沉淀。此时溶液中只含0.50mol的![]() ,求原溶液中
,求原溶液中![]() 的物质的量浓度。
的物质的量浓度。
35、等物质的量NaCO![]() 和KH CO
和KH CO![]() 的混合物9.20 g与100mL盐酸反应。
的混合物9.20 g与100mL盐酸反应。
(1)
试分析,欲求标准状况下生成的![]() 体积时,还需什么数据(用a,b等表示,要注明单位)。答:——————————————。
体积时,还需什么数据(用a,b等表示,要注明单位)。答:——————————————。
(2)
求标准状况下生成的![]() 的体积:
的体积:
| 所需数据的取值范围 | 生成的 |
| 盐酸不足时 | |
| 盐酸过量时 |
(3)
若NaCO![]() 和KH CO
和KH CO![]() 不是等物质的量混合,则9.20 g固体与盐酸完全反应时在标准状况下生成
不是等物质的量混合,则9.20 g固体与盐酸完全反应时在标准状况下生成![]() 气体的体积大于————————L;小于—————————L。
气体的体积大于————————L;小于—————————L。
高考化学模拟试卷十三 化学试题参考答案及评分标准
一、二、三(1~17题每小题3分,18~25题每小题4分,共83分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | B | B | B | D | D | BD | C | C | D | AB | BD | CD | AC |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 | B | BD | D | BC | C | A | D | C | A | A | C | D |
四、(本题包括2小题,共17分。)
| A | B | C |
| (2)(4)(7) | (5)(6)(8) | (10) |
(2)(2WV )C;互不相溶的液体。
27.(8分)(1)温度;(2)过滤;C。(3)Na![]() 和Cl
和Cl![]() ;Na
;Na![]() 可用焰色反应,
可用焰色反应,
![]()
![]() 可用AgNO
可用AgNO![]() 溶液加HNO
溶液加HNO![]() 检验;(4)重结晶(或多次结晶)
检验;(4)重结晶(或多次结晶)
五、(本题包括3小题,共17分。)
28.(1)(2分)(1)溶液里产生白色沉淀;(2)小球下沉至烧杯底部(或小球下沉),
(2)(2 分)Ba![]()
![]() +20H
+20H![]() +2H
+2H![]() +SO
+SO![]() =BaSO
=BaSO![]() ↓+2H
↓+2H![]()
29.洗衣废水含较多磷酸盐,流入江河湖泊中形成富磷的“肥水”促使水生植物过多、过性生长而污染水体(2分);Na![]() SiO
SiO![]() 能发生水解,溶液呈碱性,能使水软化,可避免水体污染。(3分)
能发生水解,溶液呈碱性,能使水软化,可避免水体污染。(3分)
30.(1)(2分)A为Na![]() SiO
SiO![]() (2分)B为BaC
(2分)B为BaC![]() 。
。
(2)(6分)[1]![]()
[2]![]()
[3] ![]()
六,(本题包括3小题,共18分。)
七(本题包括2小题,共15分。)
34.(8分)解:(1)加入的33.60g铁粉为0.60mol。而溶液中只有0.50 mol Fe![]() ,说明加入的铁粉过量.29.60g沉淀为析出的铜和余下铁的质量.
,说明加入的铁粉过量.29.60g沉淀为析出的铜和余下铁的质量.
(2)设F![]()
![]() 的物质的量为X、CuSO
的物质的量为X、CuSO![]() 的物质的量为y 加入的铁与
的物质的量为y 加入的铁与
F![]() 、
、![]() 发生如下反应:
发生如下反应:
![]()
![]()
1 mol 1mol 3mol 1 mol 1 mol 1 mol 1 mol
X X 3X y y y y
|
 |
![]()
则![]()
![]()
35.(7分)(1) 盐酸的物质的量浓度a mol![]()
(2)
|
| 2.24 aL |
|
| 2.24 L |
(3)2.06; 2.45 L。