高考化学模拟试卷十四
学校__________班级__________姓名__________
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 七 | 总 分 |
| 分数 |
注意:将选择题答在第5面答卷纸上
可能用到的数据:相对原子质量 H 1 C 12 N 14 O 16 Na 23 Al 27
S 32 Cl35.5 Ca 40 Fe 56 Cu 64 Ag 108
一、选择题(本题包括5小题,每小题3分,共15分。每小题只有一个选项符合题意)。
1.下列各组特的沸点,前者高于后者的是
(A)干冰、二氧化硅 (B)乙醛、甲醛
(C)金属汞、金属银 (D)足球烯(C60)、单晶硅
2.下列过程中,共价键被破坏的是
(A)碘升华 (B)溴蒸气被木炭吸附
(C)酒精溶于水 (D)HCL气体溶于水
3.下列关于Fe(OH)3胶体的说法不正确的是
(A)Fe(OH)3胶体与硅酸胶体混合将产生凝聚现象
(B)Fe(OH)3胶体粒子在电场影响下将向阳极运动
(C)Fe(OH)3胶体粒子不停地作布朗运动
(D)光线通过Fe(OH)3胶体时会发生丁达尔现象
4.最近医学界通过用不着14C标记的C60发现一种C60的羧酸衍生物,在特定条件下可以通过断裂DNA抑抑制艾滋病毒的繁殖,则有关14C的正确叙述是
(A)与12C60碳原子化学性质不同 (B)与此同时14N含的中子数相同
(C)是12C60的同素异形体 (D)与12C、13C互为同位素
5.下列物质属于天然有机高分子化合物的是
(A)聚2--甲基--1,3--丁二烯 (B)聚氯乙烯
(C)聚丙烯 (D)酚醛树脂
二、选择题(本题包括12小题,每小题3分,共36分,每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个都正确的给3分,但只要选错一个,该小题就为0分)
6.X、Y都是短周期元素,X原子的最外电子层上有4个电子,Y原子的最外电子层上有6个电子,则X与Y形成化合物的化学式可能为
(A)XY2 (B)X2Y4 (C)YX2 (D)XY
7.氢叠氮酸(HN3)与醋酸酸性相近,其盐稳定,但撞击发生爆炸生成氮气,有关氢叠氮酸的叙述有①NaN3的水溶液呈碱性②HN3的固体属于分子晶体③NaN3的固体属于离子晶体④ NaN3可用于小汽车防撞保护气囊
其中正确的是
(A)①②③ (B)②③④ (C)①③④ (D)全对
8.下列离子方程式中,正确的是
(A)在氯化铝溶液中加入过量氨小Al3++3OH-=Al(OH)3↓
(B)在硫酸铜溶液中加入过量氢氧化钡溶液Ba2++SO2-4=BaSO4↓
(C)在澄清石灰水中通入过量二氧化碳 OH-+CO2=HCO3-
(D)在碳酸氢钙溶液中加入过量氢氧化钠溶液Ca2++HCO3-+OH-=CaCO3+H2O↓
9.反应4NH3+5O2=4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量啬了0.3mol,则此瓜的平均速率v为
(A)![]() (O2)=0.01
mol/L·s (B)
(O2)=0.01
mol/L·s (B)![]() (H2O)=0.003
mol/L·s
(C)
(H2O)=0.003
mol/L·s
(C)![]() (NO)=0.00 mol/L·s
(D)
(NO)=0.00 mol/L·s
(D)![]() (NH3)=0.002
mol/L·s
(NH3)=0.002
mol/L·s
10.在一固定容积的密闭容器中,充入2molA和1molB发生反应:2A(气)+B(气=xC(气)达到平衡后,C的体积分数为W%,若维持容器体积和温度不变,按0.6
mol A,0.3 mol B和1.4mol C为起始物质,达到平衡后,C的体积分数也为W%,则x的值
(A)1 (B)2 (C)3 (D)4
11.X元素的简单阳离子和Y元素的简单阴离子具有与氩原子相同的电子层结构,下列叙述正确的是
(A)X的原子序数比Y的小
(B)X原子的电子层数比Y的小
(C)X的原子半径比Y的小
(D)X元素的最高正价比Y的小
12.在pH=1的含有Mg2+、Fe2+、Al3+三种阳离子的溶液中,可通用性存在的阴离是
(A)Cl- (B)NO3- (C)SO2-4 (D)HS-
13.下列说法中,正确的是(N为阿伏加德罗常数)
(A)标准状况下,22.4L任意比NO和O2的混合气体含有N个分子
(B)标准状况下,22.4L戊烷完全燃烧后放出5N个CO2分子
(C)常温常压下,1 mol任何气体单质都含有2N个原子
(D)28g乙烯含有6N对共用电子对
14.Na2S溶液中存在多种微粒,下列各微粒间的关系正确的是
(A)[Na+]>[S2-]>[OH-]>[HS-]>[H+]
(B)[Na+]+[H+]=[S2-]+[HS-]+[OH-]
(C)[Na+]=[HS-]+2[H2S]+2[S2-]
(D)[OH-]=[H+]+[HS-]+[H2S]
15.在某溶液中再溶解CH3COONa晶体后,测得溶液中[Na+]与[CH3COO-]约相等,则某溶液可能是
(A)NaOH溶液 (B)HCL溶液 (C)KOH 溶液 (D) CH3COOH 溶液
16.对尼古丁和苯并[a]芘的分子组成与结构描述正确的是
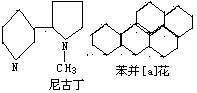
(A)尼古丁为芒香族化合物
(B)苯并[a]分子式为C20H18
(C)苯并[a]芘分子中含有苯环结构单元,
是苯的同系物
(D)尼古丁分子中的所有碳原子可能不在同一平面上,
苯并[a]芘分子中的所有氢原子可能都在同一平面上
17.人体备液的pH保持在7.35~7.45,适量的CO2可维持这个pH变化范围,可用下面化学方程式表示:![]() 。又知人体呼出的气体中CO2体积分数约5%。下列说法正确的是
。又知人体呼出的气体中CO2体积分数约5%。下列说法正确的是
(A)太快而县城太深的呼吸可以导致碱中毒(pH过高)
(B)太快而且太深的呼吸可导致酸中毒(pH过低)
(C)太浅的呼吸可以导致酸中毒(pH过低)
(D)太浅的呼吸可以导致碱中毒(pH过低)
三、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
18.在滴有甲基橙试剂的50mL 0.05 mol·L-1的一元强酸溶液中,滴入0.1mol·L-1的烧碱溶液,当滴至橙色刚好变为黄色时,所用烧碱溶液的体积为
(A)大于25mL (B)等于mL (C)小于mL (D)无法确定
19.pH=3的醋酸用水稀释,体积为原体积的2倍后,这时溶液的pH接近于
(A)1.5 (B)3.1 (C)3.5 (D)2.7
20.有机物A的结构简式为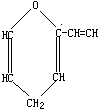 ,它的同分异构体中属于芳香族化合物的结构共有
,它的同分异构体中属于芳香族化合物的结构共有
(A)2种子 (B)3种 (C)5种 (D)6种
21.室温时pH=a的醋酸溶液与pH=b的氢氧化钠溶液等体积混合,恰好完全反应,则该溶液中醋酸的电离度可以表示为
(A)10(a+b-12)% (B)10(a+b-14)%
(C)10(16-a-b)% (D)10(14-a-b)%
22.X1和X2分别为两个恒容容器中平衡体系A(气)=2B(气)和2A(气)=B(气)的转化率,在温度不变的情况下,均啬A的物质的量。下列判断正确的是
(A)X1降低,X2增大 (B)X1、X2均降低
(C)X1增大,X2降低 (D)无法判断
23.用两支惰性电极插入500mLAgNO3溶液中,通电电解。当pH从6.0变到3.0时(设电解时阴极无氢气析出,朦胧于电解液在电解前后体积变化可以忽略),电极上应析出银的质量是
(A)2.70×10-2g (B)5.40×10-2g(C)1.08×10-1g(D)2.16×10-1g
24.在浓度为Cmol·L-1的AgNO3溶液a mL中,加入一定量pH=1的盐酸时,恰好将溶液中Ag+完全沉淀,此时得到pH=2的溶液100mL(设反应前后溶液体积变化忽不计)则C的值是
(A)0.0020 (B)0.011 (C)0.11 (D)0.22
25.把9.0g乙二酸和某二元醇混合,在一定条件下完全酯化,生成Wg环酯和3.6g水,则该醇的相对分子质量可以表示为
(A)10W -54 (B)5W+13.5 (C)45(W-3.6) (D)2W+10 .8
四、(本题包括2小题,共16分)
26.(5分)城市自来水厂供给居民使用的生活用水,常先用氯气,再用绿矾处理,以进行消毒、净化、改善水质。试用简要文字和必要的化学议程式或离子方程式表述其理由。
答:
27.(11分)
(1)阿波罗宇宙飞船使用的是氢氧燃料电池,其电极反应为:2H2+4H-4e=4H2O,O2+2H2O+4e=4OH-。正极发生的是
反应(填氧化或还原),反应方程式是 。
(2)如右图装置,A、B中的电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,合闭K2、K3通直流电则:
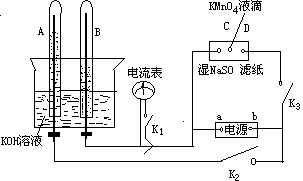
①标出电源的正、负极,a为 极,b为 极。
②在湿的Na2SO4溶液滤纸条中心的KMnO4液滴,有什么现象 。
③写出电极反应式:A中 。B中
。
④若电解一段时间后,A、B中均有气体包围电极。此时切断K2、-K3,合闭K1,则电流表的指针是否移动(填是或否) 。
⑤若电流表指针不移动说明理由,若指针移动也说明理由。
,
五、(本题包括2小题,共14分)
28.(8分)A、B、C、D、E、F为原子序数依次增大的同周期主族元素,已知A、C、F三原子的最外层共有10个电子,且这三种元素最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4,E元素原子次外层电子数比最外层电子数多3,回答:
①写出下列元素的符号:B
、D
、E
。
②用电子式写出A、F形成化合物的电子式 。
③A、C两种元素最高价氧化物的水化物反应的离子方程式 。
④D的固态氧化物是 晶体,含n mol的氧化物的晶体中含D-O共价键为 mol。
29.(6分)二氧化硅晶体是立体的网状结构。其晶体模型如下图。认真观察晶体模型并回答下列问题:
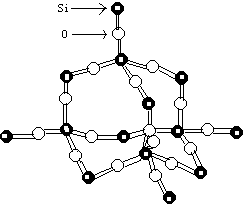
(1)二氧化硅晶体中最小环为 元环。
(2)每个硅原子为 个最小环共有。
(3)每个最小环平均拥有 个氧原子。
六、(本题包括2小题,共20分)
30.(10分)人体缺碘会影响正常的生命活动。为提高人体素质,食物补碘已引起人们的重视。据报道,人从食物中摄取碘后碘便在甲状腺中积存下来,通过一系列化学反应可形成甲状腺素。甲状腺素的结构如下:
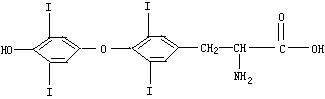
(1)甲状腺素的分子式为 。
(2)在甲状腺内,甲状腺素的合成过程可能是:
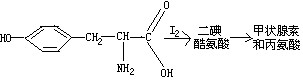
试写出上述两步反应的化学方程式,并注明反应类型。
(
)
(
)
31.(10分)已知有如下反应
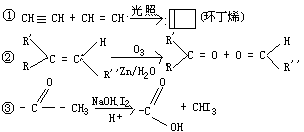
根据以下转化过程填空:
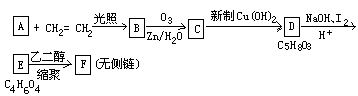
写出下列有机物结构简式:A
,B
,C
,D
,F
,
七、(本题共2小题,共17分)
32.(7分)臭氧(O3)能与K1溶液反应,生成氧气等。在反应后的溶液中滴入酚酞变为红色。若滴入淀粉则变为蓝色。为测定环境中空气的臭氧含量,将00C、1.01×105Pa的空气33.6m3通过KI溶液,使反应完全,在所得溶液中用0.0100moloL-1Na2S2O3溶液60.0mL恰好滴定达终点,反应为:
2Na2S2O3+I2→Na2S4O6+2NaI
(1)臭氧通入KI溶液中的化学方程式是 。(2)计算大气中臭氧的体积分数。
33.(10分)某工业反应混合液中仅可能含有的组分是:乙醚(C4H10O)、乙醇(C2H6O)和水。经分析,液体中各原子数之比为C:H:O=16:42:5。
(1) 若混合液中只含两种组分,则所有可能的组合是(错答要倒扣分):
。
(2) 若混合液中含有三种组分,在628g混合液中含1mol H2O,此时乙醚的物质的量各是多少?
参考答案
一、二、三(共83分)
1B 2D 3B 4D 5A 6AD 7D 8C 9BD 10BC 11D 12AC 13D 14A 15CD
16D 17AC 18C 19B 20C 21C 22A 23B 24B 25A
四(共16分)
26.(5分)

27(11分)

五、(共14分)
28(8分)①Mg、Si、P(每空1分)②Na+[ S ]2-Na+(1分)
![]()
29.(1)(6分),(2)6,(3)2(每空2分)。
六、(共20分)
30(10分)
(1)(4分)C15H11NO4I4
(2)(6分)
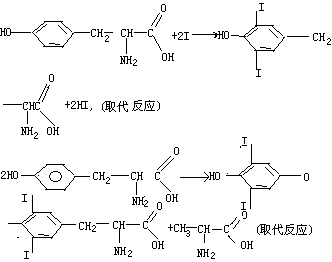
(每个方程式2分,反应类型1分)
31.(10分)
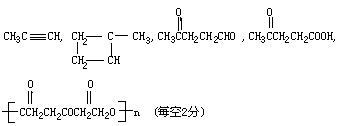
七(共17分)
32.(7分)
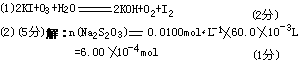
设:33.6m3空气中O3的物质质量为。
关系式:
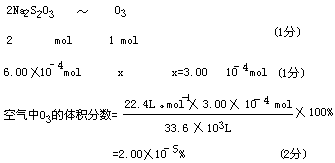
33(10分)
(1)(4分)和乙醚和乙醇,乙醚和水。(每空2分)
(2)为计算方便,按照意把该混合物写成
m=12 g.mol-1×16 mol+1 g.mol-1×42
mol+16 g.mol-1×5 mol=314 g,
628 g÷314 g.mol-1=2 mol,即628 g混合物中含32 molC. 84
mol H.和10 mlo O
(2分)
设:混合物中含a mol C4H10O和b molC2H6O.
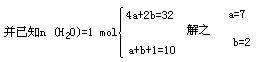
乙醚为7mol,乙醇为2mol。 (2分)