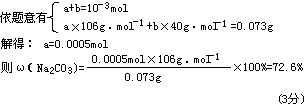高考化学模拟试卷十五
第I卷(选择题 共83分)
一、选择题(本题包括5小题,第小题3分,共15分。每小题只有一个选项符合题意。)
1.最近医学界通过用放射性14C标记的C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病,则有关14C的叙述正确的是
A.与C60中普通碳原子的化学性质不同
B.与14N含的中子数相同
C.是C60的同素异形体
D.与12C互为同位素
2.我国将全面禁止使用含铅汽油(含铅汽油中溶有能提高汽油抗震性能的四乙基铅),其主要目的是
A.减少汽车尾气中氮氧化物的排放量
B.提高汽油的燃烧值
C.消除汽车尾气中的铅对大气的污染
D.使汽油燃烧得更充分
3.1997年,英国的“克隆羊”备受世界关注。“克隆羊”的关键技术之一是找到一些特殊的酶,这些酶能激活普通体细胞使之像生殖细胞一样发育成个体。有关酶的叙述错误的是
A.酶是具有催化作用的蛋白质
B.酶的催化作用具有选择性和专一性
C.高温或重金属盐能降低酶的活性
D.酶只有在强酸性或强碱性条件下才能发挥作用
4.在相同条件下,浓度均为0.1mol· L-1的氨水和氢氧化钠溶液。前者的PH与后者的PH相比较,结论正确的是
A.小于 B.大于 C.等于 D.无法确定
5.金属R的碳酸盐的化学式为Ra(CO3)b,则该金属同价态硝酸盐的化学式为
A.R(NO3)b/a B.R(NO3)2b/a C.R(NO3)a/b D.R(N03)b/2a
二、选择题(本题包括12小题,每小题3分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
6.下列各组物质分别气化或熔化时,相邻微粒间所克服的相互作用属于同种类型的是
A.冰醋酸和醋酸钠熔化 B.二氧化硅和生石灰熔化
C.苯和干冰气化 D.金属钠熔化和冰雪融化
7.在两个相同温度和相同容积的密闭容器中,甲容器中盛入1mol氢气和1mol碘蒸气,乙容器中盛入2mol氢气和2mol碘蒸气,都发生如下反应:H2(气)+I2(气)=2HI(气),反应达平衡后,甲容器中氢气的转化率与乙容器中氢气的转化率相比较,下列结论正确的是
A.甲>乙 B.甲<乙 C.甲=乙 D.无法确定
8.下列分子中所有原子都满足最外层8电子结构的是
A.次氯酸(HCLO) B.二硫化碳(CS2)
C.三氯化磷(PCL3) D.五氯化磷(PCL5)
9.下列离子方程式书写正确的是
A.碳酸钠溶液呈碱性 CO3-2+2H2O=H2CO3+2OH-
B.用铂电极电解氯化镁溶液 2CL-+2H2O![]() CL2
CL2![]() +H2
+H2![]() +2OH-
+2OH-
C.向三氯化铁溶液中加入过量铁粉 Fe+3+Fe=2Fe+2
D.碳酸氢钙溶液受热后出现沉淀 Ca+2+2HCO3-![]() =CaCO3
=CaCO3![]() +H2O+CO2
+H2O+CO2![]()
10.设Na表示阿伏加德罗常数,则下列说法正确的是
A.在标准状况下,以任意比例混合体积为1L的乙酸和甲酸甲酯的混合物,当其完全燃烧时,生成的二氧化碳的分子数为1/11.2 NA
B.在标准状况下,体积约为22.4L的乙醇所含分子数为NA
C.在25℃和2.02×105Pa条件下,1mol氧气含有2NA个氧原子
D.12g 镁由原子变成离子时,共转移NA个电子
11.常用的锌锰干电池在放电时总反应可表示为:
Zn(固)+2MnO2(固)+2NH4+=Zn2++Mn2O3+2NH3+H2O,
放电时,下极区发生反应的物质或微粒是
A.锌 B.只有二氧化锰 C.二氧化锰和铵根离子 D.锌离子和氨分子
12.已知苯酚钠溶液中通入二氧化碳,充分反应后只能生成苯酚和碳酸氢钠;而偏铝酸钠溶液中通入二氧化碳时,可生成氢氧化铝和碳酸钠,则下列说法正确的是
A.酸性:苯酚< 氢氧化铝< 碳酸
B.结合氢离子的能力:![]()
C.同温、同浓度下溶液碱性强弱:偏铝酸钠> 碳酸钠> 苯酚钠 >碳酸氢钠
D.相同条件下,溶液的PH:碳酸氢钠 >苯酚钠> 碳酸钠
>偏铝酸钠
13.某溶液中有银离子、镁离子、亚铁离子和铝离子四种离子,若向其中加入过量的氨气,水浴加热并搅拌后过滤出沉淀,再向沉淀中加入足量的盐酸,则所得溶液中大量减少的阳离子是
A.银离子 B.镁离子 C.亚铁离子 D.铝离子
14.对复杂的有机物的结构,可以用“键线式”简化表示。如有机物CH2=CH-CHO可以简写成![]() 。则与键线式为
。则与键线式为![]() 的物质互为同分异构体的是
的物质互为同分异构体的是
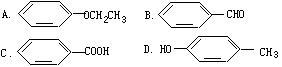
15.下列溶液混合后,常温下溶液一定呈碱性的是
A.PH=12的氢氧化钠溶液与PH=2的某酸溶液等体积混合
B.PH=2的某酸溶液与PH=12的某碱溶液等体积混合
C.PH=2的盐酸和PH=12的氨水等体积混合
D.1×10-3mol·L-1的盐酸和6×10-4mol·L-1的氢氧化钡溶液各10mL混合后再稀释100倍
16.在标准状况下,将VL的A气体(摩尔质量为Mg·mol-1)溶于0.1L水中,所得溶液密度为dg·cm-3 ,则此溶液的物质的量浓度为
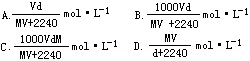
17.有某碱金属M及其相应氧化物的混合物共10g 跟足量水充分反应后,小心地将溶液蒸干,得到14g 的无水晶体。则该碱金属M可能是
A.锂 B.钠 C.钾 D.铷
三、选择题(本题包括8小题,每小题4分,共32分。第小题只有一个选项符合题意。)
18.室温下,0.1mol·L-1的某盐NaR溶液PH=10, 0.1mol·L-1某酸HR溶液PH=3,则两种溶液中水的电离度的比值是
A.1:104 B.1:1 C.1:10-7 D.无法确定
19.已知常温下有PH=2的某一元弱酸HA溶液,其电离度为5%;又知0.01mol· 的一元碱BOH溶液中![]() ,将上述两种溶液等体积混合,所得溶液中离子浓度大小关系正确的是
,将上述两种溶液等体积混合,所得溶液中离子浓度大小关系正确的是
A.[OH-] [H+] [B+] [A-]
B.[A-] [B+] [H+] [OH-]
C.[B+] [A-] [OH-] [H+]
D.[B+]=[A-] [H+]=[OH-]
20.许多物质在通常条件下是以晶体的形式存在,而一种晶体又可视作由若干相同的基本结构单元构成,这些基本结构单元在结构化学中被称作晶胞。已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如右图所示,则该物质的化学式为
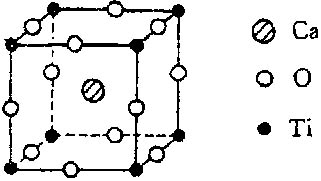
A.Ca4TiO3 B.Ca4TiO6 C.CaTiO3 D.Ca8TiO12
21.1L标准状况下的某气态烃与一定量氧气恰好完全反应,生成的二氧化碳和水蒸气换算成标准状况下的体积为bL,冷却到标准状况下则气体体积变为aL。则用a,b 表示该烃分子中碳、氢的原子个数比为
A.a:b B.a:(a-b) C.a:(b-2a) D.a:2(b-a)
22.在3BrF3+5H2O=Br2+HBrO3+O2![]() +9HF化学反应中,若有10.8g水被氧化,则被水还原的BrF3的物质的量是
+9HF化学反应中,若有10.8g水被氧化,则被水还原的BrF3的物质的量是
A0.4mol B.0.6mol C.0.8mol D.0.8mol
23.某溶液中含有两种溶质——氯化钠和硫酸,他们的物质的量之比为3:1。用石墨做电极电解该溶液时,根据反应产物,电解可明显分为三个阶段,则下列叙述不正确的是
A.阴极只析出氢气
B.阳极先析出氯气后析出氧气
C.电解最后阶段为电解水
D.电解过程中溶液的PH不断增大,最后PH为7
24.在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是
A.XY3晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数为m4
C.X和Y可属于同一周期,也可属于两个不同周期
D.X和Y一定不属于同一主族
25.常温下,向0.1mol下列物质①过氧化钠 ②磷酸钡 ③硫化钠 ④偏铝酸钠 ⑤氯化铝中分别加入0.5L水后充分搅拌,则溶液中阴离子数从大到小的排列顺序正确的是
A.⑤①③④② B.⑤②①③④ C.⑤①④③② D.②⑤①③④
第Ⅱ卷(非选择题 共67分)ⅠⅢ
四、(本题包括2小题,共17分)
26.实验室要用98%(ρ=1.84g·cm-3)的硫酸配制3.68mol·L-1的硫酸溶液500mL
(1)需准确量取98%的硫酸_________________________mL。
(2)准确量取一定体积的98%的硫酸后,要配制成3.68mol 的硫酸溶液500,必须用到的实验仪器是(填写序号)_______________________________。
①500mL量筒 ②烧杯 ③1000mL容量瓶子 ④500mL容量瓶 ⑤天平均数 ⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒 ⑨酸式滴定管
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操,将使所配制的硫酸溶液浓度偏低的是____________________________。
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒。
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶。
C.用胶头滴管向容量瓶中加水时溶液凹液面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切。
D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度相切。
27.在如下图所示的实验装置中,E为一张用淀粉、碘化钾和酚酞混合溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹;x\y分别为直流电源的两极。在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入一多孔的惰性电极。切断电源开关S1,合闭开关S2,通直流电一段时间后,请回答下列问题:
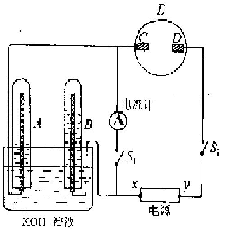
(1)标出电源的正、负极:x为______极,y为_______极。
(2)在滤纸的C端附近,观察到的现象是____________________________,在滤纸在D端附近,观察到的现象是________________________________。
(3)写出电极反应式:
A中_________________________________________;
B中_________________________________________;
C中_________________________________________;
D中_________________________________________。
(4)若电解一段时间后,A、B中均有气体包围电极。此时切断开关S2,闭合开关S1,则电流计的指针是否发生偏转(填“偏转”或“不偏转”)__________。
(5)若电流计指针偏转,写出有关的电极反应式(若指针“不偏转”,此题不必回答):A中_______________________;B中__________________________。
若电流计指针不偏转,请说明理由(若指针“偏转”,此题不必回答)________________________________。
五、(本题包括3小题,共22分)
28.在某化工生产中,要用到一种无色、可溶于水的晶体---铝铵矾。该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵。向该复盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化。
已知NH4+与ALO2-在水溶液中不能大量共存,会发生如下反应:
NH4++ALO2-+H2O=AL(OH)3![]() +NH3
+NH3![]()
试回答:
(1)硫酸铝铵在水溶液中的电离方程式为______________________________;
(2)在逐滴加入浓NaOH溶液的过程中,产生的现象有:溶液中出现白色沉淀;有刺激性气味的气体逸出;白色沉淀量逐渐增多;白色沉淀完全消失;白色沉淀量逐渐减少。请答出各种现象由先到后出现的顺序(用序号回答)
![]()
(3)写出滴入NaOH溶液的过程中,有关反应的离子方程式<1>.__________________________;
<2>.__________________________;
<3>._______________________________;
29.有元素X、Y、Z,已知X元素的-2价离子、Y元素的+1价离子的核外电子排布均与氖原子相同;Z元素最高价氧化物分子组成为Za2O3,4.5gZ元素所形成的单质与盐酸反应,在标准状况下生成5.6L氢气,Z原子核中质子数比中子数少一个。
(1)X原子的结构示意图_______;Y元素位于周期表中第_______周期、第族。
(2)用电子式表示X与Y在高温下形成稳定的化合物的过程__________________________________
(3)X、Z两种元素所形成的化合物,是工业上____________的主要原料,该反应的化学方程式为______________________________。
30.有起始时容积相同的甲、乙两个密闭容器,如下图所示。
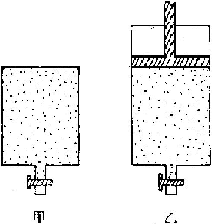
(1)在甲容器中盛入2mol三氧化硫,乙容器中盛入2mol二氧化硫和1mol氧气,如甲容器保持体积不变,乙容器保持压强不变,在相同的温度下(500)反应均达平衡。则容器内压强甲_____________ 乙,(<,><=下同),容器内混合气体的平均相对分子质量甲__________________乙,两容器中三氧化硫的体积分数甲_______________乙。
(2)若在两个容器中,甲起始加入的是2mol三氧化硫,乙起始加入的是4mol三氧化硫,相同条件下发生反应,在两容器内的温度和压强均相同的条件下,达平衡后三氧化硫的分解率甲_____________乙。若达平衡后,甲容器内三氧化硫的物质的量为amol,则乙容器内三氧化硫的物质的量_______________2a mol。
六、(本题包括2小题,共14分)
31.药用有机化合物A为一种无色液体。从A出发可发生如下图所示的一系列反。
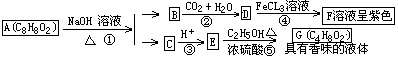
试回答:
(1)写出化合物A、B、C的结构简式:
A _________________;B______________________;C_______________。
(2)化学方程式表示如下反应:
②___________________________;⑤_______________________________。
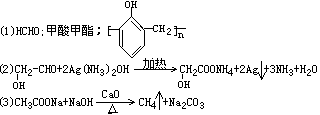
32.甲、乙、丙、丁四种有机化合物,它们的组成中均含碳40%,含氢6.67%,含氧53.33%。甲、乙、丙都能发生眼镜反应,乙、丙是丁的同分异构体。已知甲在常温下为气体,它有如下反应:甲+C6H5OH X(高分子化合物)。丁在16.6℃以下凝结为冰状晶体,丁有以下反应:丁+碳酸钠 二氧化碳+Y+水,Y在一定条件下与某无机物反应可制取最简单的烃Z。丙不能发生水解反应,但可发生酯化反应。
(1)甲的结构简式为___________________;乙的名称为_______________;X的结构简式为____________________。
(2)丙发生银镜反应的方程式为_______________________________________。
(3)写出用Y制Z的化学方程式_______________________________________。
七、(本题包括2小题,共14分)
33.将含有不溶性物质和氯化钾固体的混合物放入一定量的水中充分搅拌,有以下实验数据:
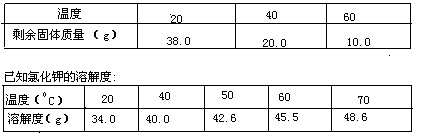
试计算:
(1)加入水的质量是____________________g;
(2)原固体混合物中氯化钾的质量是___________________g;
(3)使60℃时所得溶液变成饱和溶液,应再加入_______________g氯化钾。
34.滴定度是指每毫升标准溶液相当于被测定物质的克数,通常用![]() 表
表
示。
例如,![]() =0.056g·mL-1,表示每毫升某标准硫酸溶液恰好与0.056g氢氧化钾完全反应。
=0.056g·mL-1,表示每毫升某标准硫酸溶液恰好与0.056g氢氧化钾完全反应。
(1)某标准盐酸溶液对碳酸钙的滴定度为0.05g·mL-1,该盐酸溶液的PH为多?
(2)某不纯的硝酸银样品中Ag+的质量分数为a,取一定质量的该样品溶于水,并用上述盐酸滴定达终点,恰好消耗盐酸a ml,则该盐酸对该硝酸银样品的滴定度![]() 为多少?
为多少?
(3)某碳酸钠样品中可能混有氢氧化钠或碳酸氢钠,若以酚酞为指示剂(该指示剂变色范围为PH 8-10),仍用上述标准盐酸溶液滴定,已知盐酸对碳酸钠样品的滴定度为0.073g·mL-1,试通过计算确定该样品的成分及碳酸钠的纯度。
选择题答案:
一、(本题包括5小题,每小题3分,共15分)
1.D 2.C 3.D 4.A 5.B
二、(本题包括12小题,每小题3分,共36分)
6.C 7.C 8.BC 9.D 10.CD 11.C 12.BC 13.AC 14.D 15.CD
16.B 17.BC
三、(本题包括8小题,每小题4分,共32分)
18.C 19.B 20.C 21.D 22.A 23.D 24.C 25.A
非选择题答案:
四、(本题包括2小题,共17分)
26.(每空2分,共6分)
(1)100.00ml(如答作100ml不扣分。)
(2)②④⑥⑧
(3)A,B,C,D
27.(每空1分,共11分)
(1)X为正极,Y为负极。
(2)铂夹附近的滤纸变蓝;铂夹附近的滤纸变红。
(3)![]()
(4)偏转。
(5)![]()
(因A中H2,B中O2与KOH溶液形成H2、O2燃料电池。)
五、(本题包括3小题,共22分)
28.(每空2分,共10分)
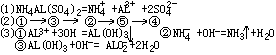
29.(每空1分,方程式2 分,共7分)

30.(每空1分,共5分)
(1)<,<,<;(2)=,=。
六、(本题包括2小题,共14分)
31.(每空1分,方程式2分,共7分)
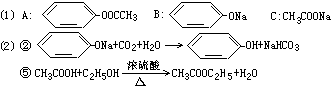
32.(每空1分,方程式2分,共7分)
七、(本题包括2小题,共14分)
33.(每空2分,共6分)
(1)300.0g; (2)130.0g (3)6.5g.(如答作300g;
130g不扣分,)
34.(8分)
解:(1)设1ml该盐酸溶液中含HCL的物质的量为X
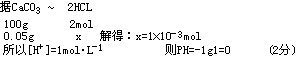
(2)设与a ml盐酸恰好反应的Ag+质量为Y
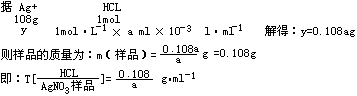
(3)已知每毫升盐酸含有10-3mol的HCL,设与之反应的碳酸钠质量为Z(以酚酞为指示
剂时,碳酸钠与盐酸反应生成碳酸氢钠和氯化钠,碳酸钠与氯化氢物质的量比为1:1)
![]()
所以,该盐酸对碳酸钠的滴定度为0.106g ml-1
分析:0.106g· ml-1>0.073g· ml-1说明样品中肯定含有NaOH,则一定没有NaHCO3
设与1ml上述盐酸反应的样品中碳酸钠和氢氧化钠的物质的量分别为a、b