高考化学模拟试卷十一
本试卷分第I卷(选择题)和第II卷(非选择题)两部分;答题时间120分钟。答题时请将第I卷答案填在II卷表格内,第II卷各题答案答在试题相应位置上。
可能用到的相对原子质量:H 1,C 12,N 14,O 16,Na 23,Mg 24,Al 27,P 31,
S 32, Cl 35.5 , Cu 64,Pb 207, Zn 65, Fe 56
第I卷(选择题,共83分)
一. 选择题(本题包括5小题,每小题3分,共15分。每小题只有一个选项符合题意)
1. 电导仪测得液态BrF3具有微弱的导电性,表明BrF3(液)中有阴、阳离子X、Y 存在,X、Y也存在于BrF2SbF6、KBrF4、(BrF2)2SnF6等离子化合物中。则X、Y的化学式分别为
(A)F-,Br3+ (B)BrF4-、BrF2+ (C)F-、BrF2+ (D)BrF4-、Br3+
2. 在无土栽培中需用浓度为0.5mol/LNH4Cl、0.16mol/LKCl、0.24mol/LK2SO4的培养液,若用KCl、NH4Cl和(NH4)2SO4三种物质来配制1.00L上述营养液,所需三种盐的物质的量正确的是
(A)0.4mol、0.5mol、0.12mol (B) 0.66mol、0.5mol、0.24mol
(C) 0.64mol、0.5mol、0.24mol (D) 0.64mol、0.02mol、0.24mol
3. 由两个氨基酸分子缩掉1个水分子可以生成二肽。丙氨酸和苯丙氨酸混合后,在一定条件下生成的二肽分子的种类有
(A) 2种 (B) 3种 (C ) 4种 (D) 5种
4. 在滴有甲基橙试液的50mL0.05mol/L的某一元弱酸溶液中,滴入0.1mol/L的NaOH溶液,当滴至橙色刚好变为黄色,半分钟不改变时,消耗NaOH溶液的体积为
(A)>25mL (B) <25mL (C) =25mL (D) 无法确定
5. 对于反应:4NH3(g) + 5O2(g) == 4NO(g) + 6H2O(g), 下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是
(A)VNH3 = 0.2mol·L-1·s-1 (B) VO2 = 0.24 mol·L-1·s-1
(C) VH2O = 0.25 mol·L-1·s-1 (D) VNO = 0.15 mol·L-1·s-1
二. 选择题(本题包括12个小题,每小题3分,共36分。每小题有一个或二个选项符合题意。)
6. 密闭容器中,反应xA(g) + yB(g) = zC(g)达平衡时,A的浓度为0.5mol/L, 若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是:
(A) x+y < z (B) 平衡向正反应方向移动
(C) B的转化率降低 (D)C的体积分数下降
7. 有人设计将两根Pt丝做电极插入KOH溶液中,然后向两极上分别通过甲烷和氧气而构成燃料电池。该电池中反应的化学方程式为:
CH4 + 2O2 + 2KOH = K2CO3 + 3H2O; 则关于此燃料电池的下列说法中错误的是(一个电子所带电量为1.6ⅹ10-19C):
(A) 通过甲烷的电极为电池的负极,通过氧气的电极为正极
(B) 在标准状况下,每消耗5.6LO2,可向外提供9.6ⅹ104C的电量
(C) 通过甲烷的电极的电极反应为:CH4 + 10OH- -8e == CO32- + 7H2O
(D) 放电一段时间后,溶液的pH值升高
|
8. 在一密闭体系中发生下列反应:
![]()
![]()
![]()
![]()
![]()
![]()
![]() A(g)+ 3B(g)= 2C(g)+热量
A(g)+ 3B(g)= 2C(g)+热量
![]() 如图所示为某一时间段中反应速率与反
如图所示为某一时间段中反应速率与反
![]()
![]() 应进程的曲线关系。下列说法正确的是:
应进程的曲线关系。下列说法正确的是:
![]()
![]()
![]() (A)t3-t4时间段时C的体积分数最高
(A)t3-t4时间段时C的体积分数最高
(B)t1时刻表示体系改变的反应条件
![]() 为升高温度
为升高温度
(C)t3时刻表示体系改变的反应条件
![]() 为采用适当的催化剂
为采用适当的催化剂
(D)t4时刻表示体系改变的反应条件
为加大压强
9.下列各组数据中,其比值为2:1的是:
(A) pH=7的氨水与(NH4)2SO4的混合液中,[NH4+]与[SO42-]之比
(B) 同温下,0.2mol/LHCOOH溶液与0.1mol/LHCOOH溶液中[H+]之比
(C) Na2CO3溶液中[Na+]与[CO32-]之比
(D) pH=12的KOH溶液与pH=12的 Ba(OH)2溶液的物质的量浓度之比
10. Fe(NO3)2溶液呈浅绿色,其中存在下列平衡:Fe2+ + 2H2O = Fe(OH)2 + 2H+,往该溶液中逐滴加入盐酸,发生的变化是:
(A)平衡向逆反应方向移动 (B)平衡向正反应方向移动
(C)溶液颜色由浅绿色变为棕黄色 (D)溶液由浅绿色变为灰绿色
11. 取pH=4的某电解质溶液1.00L,用Pt电极进行电解,经过一段时间后,测得溶液的pH=1,且阴、阳两极产物的物质的量之比为2:1,则该电解质溶液是:
(A)盐酸 (B)氢氧化钾溶液 (C)硝酸银溶液 (D)硫酸铜溶液
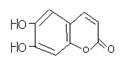
12. 中草药秦皮中含有的七叶树内酯 (环上氢原子未标出,每个折点表示一个碳原子),具有抗菌作用。若1mol七叶树内酯分别跟浓溴水和NaOH溶液完全反应,则消耗的溴和NaOH的物质的量分别为:
(A)3mol,2mol (B) 3mol,4mol (C) 2mol,3mol (D) 4mol,4mol
13. 下列离子方程式书写正确的是:
(A) 等体积、等物质的量浓度的Ca(OH)2溶液与NaHCO3溶液混合
![]() Ca2+ + 2OH-
+ 2HCO3- = CaCO3 + CO32- + H2O
Ca2+ + 2OH-
+ 2HCO3- = CaCO3 + CO32- + H2O
(B) 向10mL0.1mol/L的溴化亚铁溶液中滴入少量氯水(0.09mol/L)
2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 2Br2 + 6Cl-
(C) Ba(HCO3)2溶液与足量NaOH溶液混合:
![]() Ba2+ + HCO3- + OH- =
BaCO3 + H2O
Ba2+ + HCO3- + OH- =
BaCO3 + H2O
(D) NH4HCO3溶液与足量NaOH 溶液混合
NH4+ + HCO3- + 2OH- == NH3.H2O + CO32- + H2O
14. 与金属铝反应只能放出氢气,且一定能大量共存的离子组是
(A)NH4+、NO3-、CO32-、Na+ (B)Na+、Ba2+、Cl-、SO42-
(C)NO3-、K+、Cl-、Na+ (D)AlO2-、K+、OH-、Al3+
15.Na2CO3溶液中,存在多种分子和离子,下列关系式中正确的是
(A)[OH-]=[HCO3-] + [H+] + 2[H2CO3]
(B)[OH-] = [HCO3-] + [H+] + [H2CO3]
(C)[Na+] > [CO32-] > [HCO3-] > [OH-] > [H+]
(D) [Na+] > [CO32-] > [OH-] > [HCO3-] > [H+]
15. 某温度下重水中存在如下平衡:D2O = D+ + OD-,D2O的离子积常数为1.0x10-12,若pD= -lg[D+],该温度下有关分析正确的是
(A) 0.1molNaOD溶于重水制成1L溶液,pD = 13
(B) 将pD = 4的DCl的重水溶液稀释100倍,所得溶液pD = 6
(C ) 向30mL 0.5mol/LNaOD的重水溶液稀释100倍,所得溶液的pD=6
(D) pD=10的NaOD的重水溶液中,由重水电离出的[OD-]为1x10-10mol/L
16. 1L 0.1mol/L的AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断正确的是
(A) 电解质溶液的浓度变为0.08mol/L
(B) 阳极上产生112mLO2(标况)
(C) 转移12.04x1021个电子
(D) 反应中有0.02mol的物质被氧化
17. 下列操作一定能制得胶体的是
(A) 等物质的量浓度的KI溶液和AgNO3溶液混合
(B) 向50mL蒸馏水中滴加饱和FeCl3 溶液
(C) 向50mL蒸馏水中加入大量淀粉
(D) 向10mL 1mol/L盐酸中加入1mL水玻璃,并用力振荡
三. 选择题(本题包括8个小题,每小题4分,共32分。每小题只有一个选项符合题意)
18. 常温下,一定浓度的NaOH溶液和一定浓度的醋酸钠溶液中水的电离度之比为10-7,则这两溶液的pH之和为
(A) 14 (B) 15 (C) 21 (D) 22
19. 以铂为电极电解1L 0.5mol/L AgNO3溶液,在电路上通过0.1mol电子后,改变两个电极,电路上又通过0.2mol电子,则电解后溶液中Ag+、H+、NO3-物质的量分别为
(A) 0.2、0.2、0.5 (B)0.3、0.2、0.5
(C) 0.1、0.1、0.1 (D)无法计算
20. 已知氟化氢气体中有平衡关系:
2H3F3 = 3H2F2 - Q, H2F2 = 2HF –Q
下面有关叙述不正确的是
(A) 若气体的平均摩尔质量为40g/mol则H3F3的体积分数约为10%
(B) 若气体的平均摩尔质量为42g/mol则H3F3的体积分数小于10%
(C) 定温定容时,向题述平衡体系中充入HF气,则H3F3与HF的浓度比,数值加大
(D) 定温定容下,向题述平衡体系中充入H3F3气,则H3F3与HF的浓度比,数值加大
21. 甲、乙两个电解池均以Pt为电极,且互相串联,甲池盛有AgNO3溶液,乙池中盛有一定量的某盐溶液,通电一段时间后,测得甲池电极质量增加2.16g,乙池电极析出0.24g金属,则乙池中的溶质可能是
(A)CuSO4 (B)MgSO4 (C)Al(NO3)3 (D)Na2SO4
22. 将1L 1.00mol/L的纯碱溶液逐滴加入到1L 1.25mol/L的盐酸中,再做相反操作;将1L 1.25mol/L的盐酸逐滴加入到1L 1.00mol/L的纯碱溶液中,两次操作在同温同压下产生气体的体积比是
(A) 2:5 (B) 1:1 (C) 2:1 (D) 5:2
![]() 23.液氨溶解碱金属后成为蓝色的导电能力很强的溶液,其颜色被认为电子的氨合物[e(NH3)n]引起的,若放置蓝色逐渐褪去,蒸发褪色后的溶液可以得到白色的氨基钠(NaNH2),反应为:2Na +
2NH3 == 2NaNH2 + H2 ,据此有关说法不正确的是
23.液氨溶解碱金属后成为蓝色的导电能力很强的溶液,其颜色被认为电子的氨合物[e(NH3)n]引起的,若放置蓝色逐渐褪去,蒸发褪色后的溶液可以得到白色的氨基钠(NaNH2),反应为:2Na +
2NH3 == 2NaNH2 + H2 ,据此有关说法不正确的是
(A) 溶液褪色速率与逸出氢气的速率相对应
(B) 液氨中有电离过程:2NH3 == NH4+ + NH2-
(C) 碱金属的液氨溶液是强还原剂
(D) 液氨是一种非电解质 ,在水中才能电离
24. A、B两个烧杯中分别盛有100mL 3.0mol/L的盐酸和氢氧化钠溶液,向两个烧杯中分别加入等质量的铝粉,在相同状况下产生气体的体积比A:B = 2:5,则加入铝粉的质量为
(A)8.1g (B)6.75g (C)5.4g (D)2.7g
25.在1LK2SO4、CuSO4的混合溶液中[SO42-] = 2mol/L,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4L标况气体,则原溶液中K+的浓度为
(A)0.5mol/L (B)1mol/L (C)1.5mol/L (D)2mol/L
高三化学期中模拟练习
姓名: 学号:
一、二、三选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | |||||||||||||
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 |
成绩表
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 总分 |
| 得分 |
第II卷(共67分)
四. 实验题
26. Vc是一种水溶性维生素,其水溶液呈酸性,其分子式为C6H8O6。人体缺乏Vc易患坏血病,故Vc又称抗坏血酸。Vc易被空气中O2氧化。新鲜水果、蔬菜、乳制品中一般都富含Vc,如新鲜橙汁中Vc的含量在500mg/L左右。
某校化学课外小组测定了某品牌软包装橙汁中Vc的含量。下面是测定实验分析报告。
(一) 实验目的:测定XX品牌软包装橙汁的Vc含量。
(二) 反应原理:C6H8O6 + I2 = C6H6O6 + 2H+ + 2I-
(三) 实验用品及试剂:
(1) 仪器和用品(自选,略)
(2) 试剂:指示剂 (填名称)、浓度为7.50x10-3mol/L的标准碘溶液、蒸馏水等。
(四) 实验过程:
(1) 洗涤仪器,检查滴定管活塞是否漏夜,润洗后装好标准碘溶液待用。
(2) 打开橙汁包装,目测:颜色-橙黄色,澄清度-好。用(填仪器名称) 向锥形瓶中准确量取20.00mL待测橙汁,滴入2滴指示剂。
(3)用左手控制滴定管的 ,右手摇动锥形瓶,使液体在其中旋转起来,眼睛注视 ,直到滴定终点。滴定到反应终点的现象是
。
(五) 数据记录与处理:(请在下面空白处设计数据记录和数据处理的表格,不必填写数据。)
若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中Vc的含量是 。
(六) 问题讨论
(1)滴定时能否剧烈摇动锥形瓶?答: ,简述理由
。
(2)从分析数据看,此软包装橙汁是否是纯天然橙汁? (A.是;B.可能是;C.不是)。制造商可能采取的做法是 (A.加水稀释天然橙汁;B.橙汁被浓缩;C.将Vc作为添加剂)。你是否同意这种做法? (A.同意;B.不同意;C.调查后再作结论)。
27. 在含有Na+、Mg2+、HCO3-、SO42-的稀溶液中,各离子的物质的量之比为:
n(Na+):n(Mg2+):n(HCO3-):n(SO42-)= 2:1:2:1
(1)向该溶液中滴加2-3滴酚酞试液,溶液呈 色。有关的离子方程式为
。
(2)充分加热(1)中所得的溶液,加热过程中观察到的现象有
,完全反应后,溶液呈 色,有关的离子方程式为 。
五. 填空题
28. 将含有KCl、CuBr2、Na2SO4三种物质的水溶液(分别为1mol/L)用铂电极进行电解,且电解足够长时间。试回答:
(1)电解液的颜色变为 ,
(2)溶液中的Br-离子的变化是 ,
(3)最终溶液显 性。
29.在某条件下,容器中有如下平衡反应:A+4B=2C+D+热量。此时A、B、C的物质的量均为amol,D的物质的量为dmol。
(1)改变a的取值,再通过改变反应条件,可以使反应重新达到平衡,若限定达到新的平衡时,D的物质的量只允许在d/2和2d之间变化,则a的取值范围应是 (用a和d的关系式表示)
(2)如果要使本反应重新建立的平衡中,D的物质的量只允许在d和2d之间取值。则必须采取的措施是 (从下列选项中选择)
(A)升高反应温度(B)增大反应容器内的压强(C)增大反应容器的体积(D)降低反应温度(E)减小反应容器内的压强(F)减小反应容器体积
30. 聚氨酯的主链含有-NHCOO-重复单元的一类新型高分子化合物,其单体是氰酸酯(如O=C=N-R-N=C=O)和多元醇(如HO-R’-OH)。其高聚物结构式为:
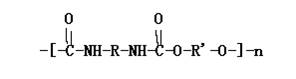 |
(1)由上述异氰酸酯和多元醇合成高聚物的反应属于 反应(填“加聚”,“缩聚”)。
( 2)写出由2,6-甲基苯二异氰酸酯(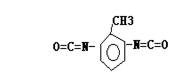 )和1,3-丙二醇为单体生成高聚物的化学方程式
。
)和1,3-丙二醇为单体生成高聚物的化学方程式
。
31. 某小型化工厂生产皓矾,结晶前的酸性饱和溶液中含有少量的Cu2+、Fe3+、Fe2+等杂质离子。为了除去杂质,获得纯净的皓矾晶体,该工厂设计如下工艺流程:
|
|
![]()
![]()
![]()
![]()
![]()
|
|
| ||||||||
![]()
![]()
|
![]()
|
![]()
![]()
|
![]()
![]() 加④
加④
![]()
|
已知:开始生成氢氧化物沉淀到沉淀完全的pH值范围分别为:
Fe(OH)3:2.7-3.7 Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8.0
试回答下列有关问题:
(1)加入的试剂①应是 ;主要的离子方程式有:
。
(2)加入的试剂②,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用 ,其理由是 。
(3)加入试剂③的目的是 。
六. 计算题
32. 双指示剂法可用来测定NaOH、NaHCO3、Na2CO3中的一种或两种物质组成的混合物的含量,具体方法是:先向待测溶液中加入酚酞,再用标准盐酸滴定,当NaOH、Na2CO3分别转化为NaCl和NaHCO3时,酚酞由红色恰好褪为无色,消耗盐酸V1mL。然后滴入甲基橙为指示剂,继续用盐酸滴定,当NaHCO3转化为NaCl时,溶液由黄色变为橙色,由消耗盐酸V2mL。
(1) 根据测定结果确定试样的成分:
| 试样 | ① | ② | ③ | ④ | ⑤ |
| 盐酸用量 | V1>V2,V2=0 | V1<V2,V1=0 | V1=V2,V2>0 | V1>V2>0 | V2>V1>0 |
| 试样成分 |
(2)取某试样:配制成1000mL水溶液,取出20.00mL,用0.1mol/L的标准盐酸滴定,测得V1=25.00mL,V2=5.00mL;求试样中成分及其质量。
33. 以石墨为电极,电解1LCuSO4和NaCl的混合溶液,其中CuSO4与NaCl的物质的量之和为0.2mol,CuSO4的物质的量占总物质的量的比值为x。
(1) 若x=0.5,当Cu2+在阴极恰好全部析出时,产生的气体是什么?物质的量为多少?所得溶液的pH值为多少?(忽略溶液体积的变化)
(2) 电解一段时间后,阴、阳极产生气体的物质的量恰好相等,均为0.16mol,试求x值。
| 高三化学期中练习答案 |
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | B | C | C | B | A | CD | D | BC | AD | AC | D | B | D |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 | B | AD | CD | D | C | B | B | A | D | D | B | D |
四.26. 淀粉(2分);酸式滴定管(或移液管)(1分); 旋塞(1分);锥形瓶内液体(1分) ; 锥形瓶内液体变蓝色(2分) 列表(3分)
| 滴定次数 | 待测橙汁体积(mL) | 标准碘溶液体积/mL | |||
| 滴定前读数 | 滴定后读数 | 体积 | 平均 | ||
| 1 | |||||
| 2 | |||||
(六)(1)否(1分);因为Vc易被空气中O2氧化,剧烈摇动会影响测定结果
(2)C、C、C (各1分)
27.(1)浅红色或粉红色(1分);HCO3- + H2O == H2CO3 + OH-
(2)产生气体(无色)、溶液变浑、红色加深(2分);红(1分);Mg2+ + 2HCO3- == Mg(OH)2 + 2CO2 (2分)
五.28.(1)无色(2分); (2)先氧化为Br2,又与碱反应生成BrO3-、BrO-等(2分,答出BrO-即可); (3)碱(2分)
29.a>4d(3分) ;D(3分)
30.(1)加聚(2分);(2)略(2分)
31.(1)Zn(1分);Zn + Cu2+ = Cu + Zn2+;Zn + 2Fe3+ = 2Fe2+ + Zn2+ (2分)
(2)H2O2(1分);当氧化剂,又不带入其他杂质(2分)
(3)调节溶液的pH值(1分)
六.32.(1)NaOH;NaHCO3;Na2CO3;NaOH、Na2CO3;Na2CO3、NaHCO3(5分)
(2)成分为NaOH、Na2CO3的混合物(1分);
NaOH:4.0g(2分);Na2CO3:2.65g(2分)
33. (1) n(Cu2+) = 0.1mol;n(Cl-) = 0.1mol
Cu2+ -------2Cl---------Cl2
0.05mol 0.1mol 0.05mol 余Cu2+ 0.05mol(1分)
2Cu2+-------4OH- --------O2 ----------------4H+
0.05mol 0.025mol 0.1mol (2分)
则产生气体为氯气0.05mol;氧气0.025mol。
[H+] = 0.1mol/L,pH = 1 (1分)
(2)阴极产物为:n(Cu) = 0.2xmol , n(H2) = 0.16mol
阳极产物为:n(Cl2) = 0.1(1-x)mol, n(O2) = [0.16-0.1(1-x)]mol(2分)
依据电子守衡:x = 0.6(2分))
( 注:选择题第2个15题不要)