高考化学模拟试题
命题人:江苏省阜宁中学 刘海平
班级 学号 姓名
(请将第一、二两题的答案填入下表中)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
一、 选择题(每题只有一个正确答案):
1、为防止工业制硫酸的尾气中SO2污染大气,常选用的尾气吸收剂是: ( )
A、水 B、浓H2SO4 C、氨水 D、氢氧化钠
2、为了除去蛋白质溶液中混有的少量食盐,可采用的方法是: ( )
A、过滤 B、渗析 C、电解 D、加入AgNO3溶液、过滤
3、下列实验中:①配制一定物质的量浓度的溶液;②pH试纸的使用;③过滤;④蒸发。均需用到的仪器是: ( )
A、试管 B、胶头滴管 C、漏斗 D、玻璃棒
4、25℃时,将等体积甲酸溶液和苛性钠溶液混合后,若混和液中C(Na+)=C(HCOO-),则溶液的pH为: ( )
A、大于7 B、小于7 C、等于7 D、无法确定
5、下列化学式对应的结构式从成键情况看不合理的是: ( )
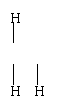 |
A、CH5N, H—C—N—H B、HClO,H—O—Cl
![]()
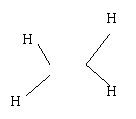
C、CH4S,H—C—S—H D、CH4Si , Si—C
6、为了使NaHS溶液中的C(Na+)/C(HS-)的比值变为1,可加入的物质是: ( )
A、适量NaOH B、适量盐酸 C、适量KOH D、适量KHS
7、下列家庭化学小实验不能达到预期目的的是: ( )
A、用米汤检验食用加碘盐(含KIO3)中含碘
B、用醋、石灰水验证蛋壳中含有碳酸盐
C、用碘酒验证汽油中是否含有不饱和烃
D、用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验
8、下列各种变化中,不属于化学变化的是: ( )
A、向鸡蛋白溶液中滴入饱和硫酸铵溶液,析出白色沉淀
B、加热胆矾得到白色的无水硫酸铜粉末
C、向沸水中滴入饱和氯化铁溶液,制取氢氧化铁胶体
D、向鸡蛋白溶液中滴入硝酸铅溶液,析出白色沉淀
二、选择题(每题有一到两个正确答案):
9、碳氢化合物是一种大气污染物,下列现象与碳氢化合物有关的是: ( )
A、火山爆发 B、酸雨 C、光化学烟雾 D、臭氧空洞
10、取pH均等于2的盐酸和醋酸各100mL分别稀释2倍后,再分别加入0.065g Zn粉,在相同条件下充分反应,有关叙述正确的是: ( )
A、醋酸与锌反应放出的H2多
B、盐酸和醋酸分别与锌反应放出的H2一样多
C、盐酸和醋酸分别与锌反应的速率一样大
D、醋酸与锌反应的平均速率比盐酸与锌反应的平均速率大
11、在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉并充分搅拌。试分析有关反应并作出判断,下列结论中不正确的是: ( )
A、所得溶液中Cu2+与Fe2+物质的量比为1:2
B、所得溶液中不含Fe3+、Ag+
C、反应后有Cu、Ag析出
D、离子氧化性:Ag+>Cu2+>Fe3+Zn2+
12、下列离子方程式不正确的是: ( )
A、过量氯水与FeI2溶液作用
2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
B、碳酸钙溶于醋酸
CaCO3+2H+=Ca2+CO2↑+H2O
C、在烧碱溶液中通入少量SO2气体
SO2+2OH- = SO32-+H2O
D、向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+刚好沉淀完全
Ba2++OH-+H++SO42-=BaSO4↓+H2O
13、下列反应达到平衡后,降温或加压时平衡都向逆方向移动的是: ( )
A、2NH3(g)==N2(g)+3H2(g) ΔH>0
B、2HI(g)==H2(g)+I2(g) ΔH>0
C、CaO(s)+CO2(g)==CaCO3(s) ΔH<0
 D、4NH3(g)+5O2(g)==4NO(g)+6H2O(g) ΔH<0
D、4NH3(g)+5O2(g)==4NO(g)+6H2O(g) ΔH<0
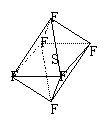
14、SF6是一种无色气体,具有很强的稳定性,可用于灭火。SF6的分子结构如图所示,呈正八面体型(S原子处于中心)。如果其中有两个F原子被Cl原子所取代,所形成的分子有: ( )
A、2种 B、3种 C、4种 D、5种
15、在密闭容器中,反应2SO2(g)+O2(g)= 2SO3(g)(ΔH<0),在一定条件下达平衡状态,此时SO2、O2、SO3物质的量之比为3:2:5,其它条件不变,改变温度后达新的平衡状态,此时容器中含SO2 1.4mol,SO3为 1.8mol,则新平衡时含O2的物质的量为: ( )
A、0.72 B、0.90 C、0.93 D、1
16、有下列两种假设:
⑴一种碱溶液与一种盐溶液混合完全反应后,生成一种强碱性物质;
⑵两种酸溶液混合完全反应后,溶液的酸性减弱。确有具体例证存在的是: ( )
A、只有⑴ B、只有⑵ C、⑴和⑵ D、都不存在
17、N、M两种元素,已知N是短周期元素,且N2-与M+的电子数之差为8,则下列说法正确的是: ( )
A、N和M原子的电子总数之和可能为11
B、N和M的原子序数之差为8
C、N和M原子的最外层电子数之和为8
D、N和M原子的最外层电子数之差为7
18、下列操作正确的是: ( )
A、金属钠密封保存在冷水中
B、用二硫化碳清洗沾有红磷的试管
C、用适量苯和液溴混合制溴苯时,只需加铁屑,不必加热
D、在制取乙酸乙酯的实验中,将导管伸进饱和碳酸钠溶液
三、实验题:
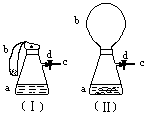
19、图(I)中瓶a内放入20毫升6摩/升盐酸,b是未充气的气球,里边放有4克碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气)。将图(I)的装
|
|
置在托盘天平上称量,质量为W1克。
根据实验现象填写下列空白:
(1)把气球b中的碳酸钙粉末小心地倒入
瓶中,立即产生许多气泡,气球逐渐
胀大(图II)。反应结束后,再次称量,
质量为W2克。则W2和W1的关系
是 。
(2)取25毫升6摩/升NaOH溶液。先用滴管取少量NaOH溶液,滴管插入胶管c口(为便于操作,可以适当倾斜瓶a,注意防止漏气)。打开d,将溶液挤入瓶中,立即夹紧d。可以看到瓶内产生少量白色沉淀,轻轻摇动瓶a,沉淀随即消失。用同样方法再加入少量NaOH溶液,又产生白色沉淀,轻摇,沉淀又消失。使沉淀消失的反应的化学方程式是 。
(3)将全部NaOH溶液很快加入瓶中,夹紧d,瓶内产生大量白色沉淀,不再溶解,此时瓶内温度 (填 “ 不变”、“降低”或“升高”)。
(4)继续轻摇瓶a,气球逐渐缩小,直至恢复反应前的下垂状。写出这时发生的反应的化学方程式。 。
20、下面a~f是中学化学实验中常见的几种仪器:
a.量筒 b.容量瓶 c.试管 d.圆底烧瓶 e.滴定管 f.托盘天平
⑴其中要标示出仪器具体使用温度的是___________(填写编号);
⑵可用作反应器并能进行加热的是____________(填写编号);
⑶用已知浓度的稀烧碱溶液滴定未知浓度的稀盐酸溶液,若滴定前平视读数,滴定终点时俯视读数。所测定的盐酸浓度结果_________(填:“偏大”、“偏小”、“正确”)
四、填充题:
21、已知:(CH3)2CHCOOR![]() CH2=C(CH3)COOR
CH2=C(CH3)COOR
RCH=CH2![]() RCH(CH3)CHO
RCH(CH3)CHO
今有A、B、C、D、E、F六种有机物,它们所含的元素不超过C、H、O三种,这六种有机物的转化关系如下:
A![]() B
B![]() C®D
C®D![]() E
E![]() F
F
其中A和D摩尔质量分别是82g/mol和202g/mol。A是无支链的烃;B可发生银镜反应;C可被碱中和;D无酸性;而F是高分子化合物,其化学式是(C10H14O4)n。试回答:
(1)结构简式:A:
E:
。
(2)反应类型:C®D是 ;E®F是
。
(3)化学方程式:B与足量新制的Cu(OH)2悬浊液在加热时反应:
。
22、某酸HX和某碱MOH,25℃下两溶液的pH之和等于a。
⑴若HX为强酸,MOH为强碱,等体积混合后,pH<7,则a________14(填=,>或<)
⑵若HX为强酸,MOH为弱碱,等体积混合后,若a=14,则混合后溶液的pH__________7(填=,>或<)
⑶25℃下,若要使由水电离出的 C(H+)>1×10-7mol·L-1,应采取的措施是__________(填字母)。
A、加入 明矾 B、加入NaHSO4 C、加入Na2O
D、加入Na2CO3 E、通入CO2 F、通入NH3
23、在一定条件下,不许添加别的反应物,经不同的化学反应,可实现如下图的各种变化。其中,反应③、④、⑤属氧化还原反应,而反应①、②属非氧化还原反应。X、F和Y为单质(其余为化合物),且B是无毒气体,F是空气的主要成分之一,Z中阴、阳离子电子层结构相同,据此填空。
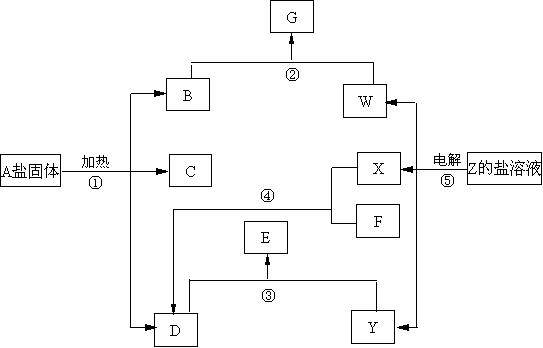
(1)物质A是: ;F是: ;X是: 。Y是: 。
(2)写出反应②的化学方程式: 。
(3)写出反应④的化学方程式: 。
24、已知重铬酸钾(K2Cr2O7)可与浓盐酸反应生成Cl2、CrCl3、KCl和水。
⑴请写出并配平上述反应的化学方程式。________________________________
⑵此反应中浓盐酸显示的性质为_______(从下列项中选择填空)
A、氧化性 B、还原性 C、酸性
⑶此反应的离子反应方程式可表示为(K2Cr2O7、CrCl3均为易溶于水,易电离的盐)_________________________________________________
⑷将上述反应产生的Cl2通入盛有足量NH3的集气瓶,反应剧烈,并产生大量白烟(发生置换反应)试写出有关反应的化学方程式_____________ 。
⑸在上述反应过程中,若反应消耗K2Cr2O70.2mol,产生的Cl2在⑷反应中最多消耗的NH3为___________mol。
五、计算题:
25、24.42g表面已形成铜绿[Cu2(OH)2CO3]的铜片与足量稀盐酸反应,生成标况下的CO2 224mL。
①写出有关反应的离子方程式。
②求原铜片中铜单质的质量分数。(保留三位有效数字)
26、滴定度是指每毫升标准溶液相当于被测定物质的克数,通常用g/ml表示。例如,标准硫酸溶液滴定氢氧化钾溶液的滴定度为0.056g/ml,表示每毫升某标准硫酸溶液恰好与0.056g氢氧化钾完全反应。(将答案填入横线上,不必写计算过程。)
⑴某标准盐酸溶液对碳酸钙的滴定度为0.05g/ml,该盐酸溶液的PH为_______。
⑵某不纯的硝酸银样品中Ag+的质量分数a,取一定质量的该样品溶于水,并用上述盐酸滴定到终点,恰好消耗盐酸aml ,则该盐酸对该硝酸银样品的滴定度为_____________。
⑶某碳酸钠样品中可能混有氢氧化钠或硫酸氢钠,若以酚酞为指示剂(该指示剂变色范围为PH8-10),仍用以上标准盐酸溶液滴定,已知盐酸对碳酸钠样品的滴定度为0.073g/ml,试通过计算确定该样品中碳酸钠的纯度: _____________。
高考化学模拟试题
参考答案
一、二题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | B | D | C | D | D | A | A | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | AD | CD | AB | A | A | B | C | A | C |
三、实验题:
19、
(1) w1=w2
(2) Ca(OH)2+2HCl===CaCl2+2H2O
(3) 升高
(4) CO2+2NaOH===Na2CO3+H2O Ca(OH)2+CO2===CaCO3+H2O
20、(1)a、b、e (2)cd (3)偏小
21、A是CH2=CHCH2CH2CH=CH2,
|
|
(2)反应类型C®D是酯化反应;E®F是加聚反应
(3)
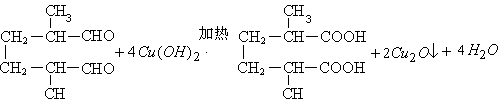
22、(1) < (2) > (3) A
23、(1)A是:(NH4)2CO3或NH4HCO3;F是: N2 ;X是: H2 。Y是: Cl2 。
(2)写出反应②的化学方程式: CO2+2KOH==== K2CO3 + H2O 。
(3)写出反应④的化学方程式:N2 + 3H2 ![]() 2NH3 。
2NH3 。
24、(1)K2Cr2O7 +14HCl====3Cl2↑ + 2CrCl3 + 2KCl + 7H2O
(2) BC (3) )Cr2O72- +14H++6Cl-====3Cl2↑+ 2Cr3+ + 7H2O
(4) 8NH3+3Cl2 ====N2+6NH4Cl (5) 1.6
25、①Cu2(OH)2CO3 +4H+==2Cu2++3H2O+CO2↑②Cu%=90.9%
26、⑴ PH=0 ⑵![]() ⑶72.6%
⑶72.6%