高考化学试题卷3
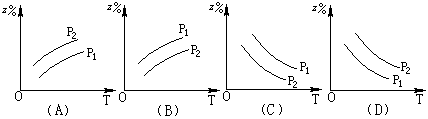 |
1. 如图所示,反应:X(气)+3Y(气)
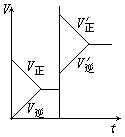 2. 对于达平衡的可逆反应X+Y
2. 对于达平衡的可逆反应X+Y![]() W+Z,增大压强则正、逆反应速度(v)的变化如右图,分析可知X,Y,Z,W的聚集状态可能是
W+Z,增大压强则正、逆反应速度(v)的变化如右图,分析可知X,Y,Z,W的聚集状态可能是
(A)Z,W为气体,X,Y中之一为气体
(B)Z,W中之一为气体,X,Y为非气体
(C)X,Y,Z皆为气体,W为非气体
(D)X,Y为气体,Z,W中之一为气体
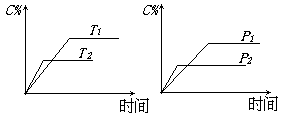 3. 可逆反应mA(固)+nB(气)
3. 可逆反应mA(固)+nB(气)![]() eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如右图。下列叙述正确的是
eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如右图。下列叙述正确的是
(A)达平衡后,加入催化剂则C%增大 (B)达平衡后,若升温,平衡左移
(C)化学方程式中n>e+f (D)达平衡后,增加A的量有利于平衡向右移动
 4. 反应aA(g)+b(B)(g)
4. 反应aA(g)+b(B)(g)
![]() c(C)(g)+Q,生成物C的质量分数与压强P和温度的关系如右图,方程式中的系数和Q值符合图象的是( )
c(C)(g)+Q,生成物C的质量分数与压强P和温度的关系如右图,方程式中的系数和Q值符合图象的是( )
(A)a+b>c Q>0 (B)a+b>c Q<0
(C)a+b<c Q<0 (D)a+b=c Q>0
5. 在可逆反应mA(g)+nB(g)![]() pC(g)+Q中m、n、p为系数,且m+n>p Q>0。分析下列各图,在平衡体系中A的质量分数与温度toC、压强P关系正确的是
pC(g)+Q中m、n、p为系数,且m+n>p Q>0。分析下列各图,在平衡体系中A的质量分数与温度toC、压强P关系正确的是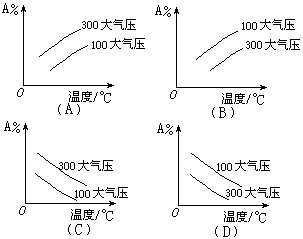
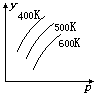 6.右图中表示外界条件(t、p)的变化对下列反应的影响:L(固)+G(气)
6.右图中表示外界条件(t、p)的变化对下列反应的影响:L(固)+G(气)![]() 2R(气)-Q,y 轴表示的是
2R(气)-Q,y 轴表示的是
(A) 平衡时,混合气中R的百分含量
(B) 平衡时,混合气中G的百分含量
(C) G的转化率 (D) L的转化率
7. 在密闭容器中进行下列反应:M(气)+N(气)![]() R(气)+2L
R(气)+2L
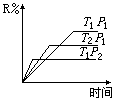 此反应符合右图,下列叙述是正确的是
此反应符合右图,下列叙述是正确的是
(A) 正反应吸热,L是气体 (B) 正反应吸热,L是固体
(C) 正反应放热,L是气体 (D) 正反应放热,L是固体或液体
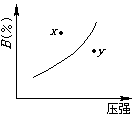
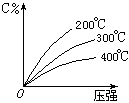
![]() 8. 对于mA(固)+nB(气) pC(气)+Q的可逆反应,在一定温度下B的百分含量与压强的关系右图所示,则下列判断正确的是
8. 对于mA(固)+nB(气) pC(气)+Q的可逆反应,在一定温度下B的百分含量与压强的关系右图所示,则下列判断正确的是
(A)m+n<p (B)n>p
(C)x点的状态是v正>v逆 (D)x点比y点的反应速度慢
9. 在一定条件下,反应A(气)+B(气)![]() C(气)+Q达到平衡后,根据下列图象判断
C(气)+Q达到平衡后,根据下列图象判断
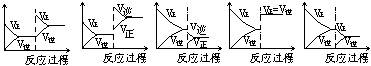 A. B. C. D. E.
A. B. C. D. E.
(1)升温,达到新的平衡的是( ) (2)降压,达到新的平衡的是( )
(3)减少C的量,移向新平衡的是( ) (4)增加A的量,移向新平衡的是( )
 (5)使用催化剂,达到平衡的是( )
(5)使用催化剂,达到平衡的是( )
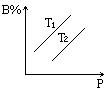
10. 反应aA(固)+bB(气)![]() cC(气)+dD(气)达到平衡时,B%跟压强P和温度T(T2>T1)之间的关系如图所示:
cC(气)+dD(气)达到平衡时,B%跟压强P和温度T(T2>T1)之间的关系如图所示:
(1)当压强不变时,升高温度,B%变______,其反应为_______热反应。(2)当温度不变,增大压强时,B%变_______,平衡向______方向移动,方程式中系数间关系是______________。
(3)当温度不变,增大压强时,若B%不变,则方程式中系数关系是_____________。
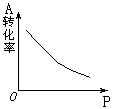 11. 密闭容器中mA(g)+nB(g)
11. 密闭容器中mA(g)+nB(g)![]() pC(g),反应达到平衡,经测定增大压强P时,
pC(g),反应达到平衡,经测定增大压强P时,
A的转化率随P而变化的曲线如右图。则:
(1)增大压强,A的转化率____,平衡向____移动,
达到平衡后,混合物中C的质量分数________。
(2)上述化学方程式中的系数m、n、p的正确关系是____,
向上述平衡体系中加入B,则平衡________。
(3)当降低温度时,C的质量分数增大,则A的转化率____,正反应是____热反应。
12、A+、B+、C-、D-四种离子两两组成四种可溶性盐,其中:AC盐和BD溶液pH=7,BC盐溶液pH>7,则下列说法不正确
A、AD盐溶液pH>7、 B、在AC盐溶液中:c(A+)+c(AOH)=c(C-)+c(HC)
C、将AD盐和BC盐等物质的量混合溶于水,溶液pH=7 D、酸的电离度一定是:HD>HC
13、物质的量浓度相同(0.1mol/L)的弱酸HX和NaX溶液等体积混合,溶液中微粒浓度关系错误的是
A、c(Na+)+ c(H+)=c(X-)+ c(OH-) B、c(HX)+ c(X-)=2 c(Na+)
C、若溶液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
D、若溶液呈碱性,则c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
14、已知H2PO4-以电离为主。在0.1mol/L的NaH2PO4溶液中,下列微粒浓度关系不正确的是
A、c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)
B、c(H3PO4)+ c(H+)= c(OH-)+ c(HPO42-)+2c(PO43-)
C、c(Na+)=3c(PO43-)+2c(HPO42-)+c(H2PO4-)+ c(H3PO4)
D、c(Na+)>c(H2PO4-)>c(H+)>c(HPO42-)>c(H3PO4)
15、等体积混合0.1mol/L的盐酸和0.06mol/L的Ba(OH)2溶液后,溶液的pH等于
A、2.0 B、12.3 C、1.7 D、12.0
16、,将某强酸和强碱按溶液的体积比1:10混合后溶液恰好呈中性,则混合强酸与强碱的pH之和是
A、12 B、13 C14 D、15
17、25℃时,0.1mol/L的一元酸HA溶液和0.1mol/L的一元碱BOH溶液的pH之和为13,现将两溶液等体积混合,下列有关叙述中正确的是
A、酸HA溶液的pH可能为1 B、混合溶液中c(A-)=c(B+)
C、混合溶液显碱性 D、碱BOH一定是弱碱
18、室温下某种一元酸(HA)溶液中加入一定量的一种强碱(MOH)溶液,恰好完全反应,则有关反应后溶液的判断中一定正确的是
A、c(A-)≤c(M+) B、c(A-)≥c(M+)
C、若反应后溶液的pH=7,则c(A-)>c(OH-) D、若反应后溶液的pH<7,则c(A-)<c(OH-)
19、Na2HPO4溶液中存在如下电离平衡:HPO42-![]() H++PO43-,欲使溶液c(HPO42-)、c(H+)、c(PO43-)均减小,可采用的方法有
H++PO43-,欲使溶液c(HPO42-)、c(H+)、c(PO43-)均减小,可采用的方法有
A、加盐酸 B、加石灰 C、加烧碱 D、加水稀释
20、25℃时,0.1mol/LNaX溶液中水的电离度为α1,0.1mol/L的盐酸中水的电离度为α2,若α1/α2=109,则NaX溶液的pH约为
A、4 B、5 C、9 D、10
答案:1、C 2、A C 3、B 4、A 5、B 6、B 7、C 8、C D 9、B C E A D
10、大 放 大 逆 b<c+d b=c+d 11、降低 逆反应 m+n<p 向正反应方向移动 增大 放 12、A 13、D 14、C 15、D 16、B 17、AD 18、AC 19、B 20、D