高考化学复习热点内容
专题训练(三)原子结构 元素周期律 化学键 晶体结构
1、下列分子中所有原子均满足最外层8电子结构的是
A、LiCl B、NCl3 C、PCl5 D、CS2
2、1999年曾报导合成和分离了含高能量的正离子N5+ 的化合物N5AsF6,下列叙述错误的是
A.N5+共有34个核外电子 B.N5+中氮氮原子间以共用电子对结合
C.化合物N5AsF6中As化合价为+1 D.化合物N5AsF6中F化合价为-1
3、下列说法中正确的是
A.次外层电子数是2或8或18的原子一定是主族元素
B.离子化合物中任何情况下都不存在分子
C.质量数表示同位素原子量的近似值
D.核外电子排布相同的微粒,一定具有相同的化学性质
4、X和Y是短周期元素,两者能组成化合物X2Y3,已知X原子序数为n,则Y的原子序数不可能是
A、n+11 B、n+3 C、n-5 D、n-6
5、能与氢氧化钠溶液反应的原子晶体是
A、铝 B、金刚石 C、硅 D、二氧化硅
6、共价键、金属键、离子键和分子间作用力都是构成物质微粒间的不同相互作用,含有上述中两种相互作用的晶体是
A、SiO2晶体 B、CCl4晶体 C、NaCl晶体 D、NaOH晶体
7、近来查明,二氧化三碳(C3O2)是金星大气层的一个组成部分,下列关于二氧化三碳的说法错误的是 .. ..
A、二氧化三碳的电子式为 :O::C::C::C::O: B、C3O2、CO、CO2都是碳的氧化物
C、C3O2和CO一样可以燃烧生成CO2 D、C3O2和CO2都是碳酸的酸酐
8、下列排列顺序错误的是
A、金属性 Rb>K>Mg>Al B、非金属性 As>S>Cl>F
C、稳定性 AsH3>PH3>H2S>HF D、半径 Na>P>O>F
9、下列过程中,共价键被破坏的是
A.碘升华 B.溴蒸气被木炭吸附
C.NaCl溶于水 D.HCl气体溶于水
10、短周期元素A、B、C原子序数依次递增,它们的原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数。下列叙述正确的是
A 原子半径A<B<C B A的氢化物的稳定性大于C的氢化物
C B的氢化物的熔点比A氧化物高 D A与C可形成离子化合物
11、第3周期元素R,它的原子核外最外层上达到饱和所需电子数小于次外层和最内层电子数之差,且等于最内层电子数的正整数倍。则关于R的正确说法是
A 常温下,能稳定存在的R的高价氧化物都能与烧碱溶液反应
B R的最高价氧化物对应水化物是强酸
C R和R的氧化物的熔点和硬度都很高
D R能形成稳定的气态氢化物
12、许多物质在通常条件下是以晶体的形式存在,而一种晶体又可视作若干相同的基本结构单元构成,这些基本结构单元在结构化学中被称作晶胞。已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为
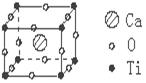
A.Ca4TiO3 B.Ca4TiO6
C.CaTiO3 D.Ca8TiO12
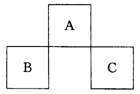 13、A、B、C均为短周期元素,它们在周期表中的位置如左图所示。
13、A、B、C均为短周期元素,它们在周期表中的位置如左图所示。
已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B、C两元素的核电荷数之和是A元素原子序数的4倍。则A、B、C分别是
A C、Al、P B N、Si、S C 0、P、Cl D F、S、Ar
14、正电子、反质子等都属于反粒子,它们跟普通电子、质子的质量、电量均相等,而电性相反。科学家设想在宇宙的某些区域可能存在完全由反粒子构成的物质——反物质。1998年初和年底,欧洲和美国的科研机构先后宣布:他们分别制造出9个和7个反氢原子,这是人类探索反物质的一大进步。你推测反氢原子是:
A 由1个带正电的质子和1个带负电的电子构成
B 由1个带负电的质子和1个带正电的电子构成
C 由1个不带电的中子和1个带负电荷的电子构成
D 由1个带负电荷的质子和1个带负电荷的电子构成
15、 镭(Ra)位于周期表的第七周期ⅡA族。下列关于镭的性质的描述不正确的是
A. 在化合物中呈+2价 B. 单质能使水分解产生氢气
C. 氢氧化物呈两性 D. 碳酸盐难溶于水
16、NH3分子与H+间以 键结合成NH4+的过程可用电子式表示为: 。
17、下表标出的是元素周期表的一部分元素,回答下列问题:
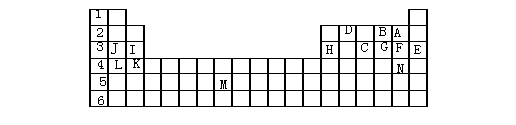 |
(1)表中用字母标出的15种元素中,化学性质最不活泼的是
(用元素符号表示,下同),金属性最强的是
,非金属性最强的是
,常温下单质为液态的非金属元素是
,属于过渡元素的是 (该空用字母表示)。
(2)B,F,C气态氢化物的化学式分别为 ,其中以
最不稳定。
(3)第三周期中原子半径最小的是 。
18.按要求回答下列问题
(1)石墨晶体中C-C键的键角为 。其中平均每个六边形所含的C原子数为 个。
(2)金刚石晶体中含有共价键形成的C原子环,其中最小的C环上有 个C原子。
(3)CsCl晶体中每个Cs+周围有 个Cl-,每个Cs+周围与它最近且距离相等的Cs+共有 个。
(4)白磷分子中的键角为 ,分子的空间结构为 ,每个P原子与 个P原子结合成共价键。若将1分子白磷中的所有P-P键打开并各插入一个氧原子,共可结合 个氧原子, 若每个P原子上的孤对电子再与氧原子配位,就可以得到磷的另一种氧化物 (填分子式)。
(5)二氧化硅是一种 晶体,每个硅原子周围有 个氧原子。
(6)试判断:①SiO2,②CO2,③CS2 晶体的熔点由高到低排列的顺序是 .(填相应物质的编号)。
19、已知X、Y、Z、W四钟元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z、W四种元素的符号:
X 、Y 、Z 、W
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为 。
(3)由X、Y、Z所形成的离子化合物是 ,它与W的最高氧化物的水化物的浓溶液加热时反应的离子方程式是 。