高考化学科目教学质量第一次检测
化学试题卷
考生须知:
1.本卷满分100分,考试时间100分钟。
2.答题前,在答题卷密封区内填写学校、班级和姓名。
3.所有答案及必须写在答题卷上,写在试卷上无效。
4.考试结束,只需上交答题卷。
可能用到的相对原子质量:H 1 C 12 N 14 O 16
一、选择题(每小题只有一个选项符合题意,每小题2分,共16分)
1.环境污染已成为人类社会面临的重大威胁,各种污染数不胜数。下列名词与环境污染无关的是
① 温室效应 ② 赤潮 ③ 酸雨 ④ 光化学污染 ⑤ 臭氧空洞
⑥ 水俣病 ⑦ 潮汐 ⑧ 大脖子病
A. ①② B. ⑦⑧ C. ⑥⑦⑧ D. ②⑤⑦
2.美国在阿富汗战场上又使用了贫铀弹,贫铀弹的主要成分是低放射性的铀238,它与制造原子弹的铀235属于
A. 同位素 B. 同种原子 C. 同分异构体 D. 同素异形体
3.下列物质固态时,必定是分子晶体的是
A. 酸性氧化物 B. 非金属单质 C. 碱性氧化物 D. 含氧酸
4.自古以来人们就知道酒在空气中能“酸败成醋”,该事实的实质是
A. 酒中的乙醇挥发,使乙醇含量降低 B. 酒中的乙醇被氧化生成乙醛
C. 酒中的乙醇被氧化成乙酸 D. 酒中的杂质腐败成酸
5. 某同学在所收到的信封上发现有收藏价值的邮票,便将邮票剪下来浸在水中,以便去掉邮票背面的粘合剂。根据“相似相溶”的原理,该粘合剂的成分可能是
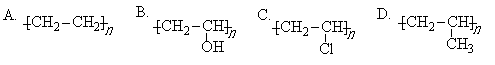
6.“混盐”是指一种金属离子与多种酸根离子构成的盐,如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐。“复盐”是指含有多种简单阳离子和一种酸根阴离子的盐如KAl(SO4)2,下列各化合物中属于混盐的是
A. CaOCl2 B. (NH4)2 Fe (SO4)2 C. BiONO3 D. K3[Fe(CN)6]
7.镍氢电池是近年来开发出来的可充电电池,它可取代会产生镉污染的镍镉电池。镍氢电池的总反应式是
|
|
根据此反应式判断,下列叙述正确的是
A. 电池放电时,某电极上电极反应为:Ni3++e —→ Ni2+
B. 电池放电时,H2是负极
C. 电池充电时,镍元素被还原
D. 电池放电时,Ni(OH)2的含量不断减少
8.被誉为“太空金属”的钛,在室温下,不与水、稀硫酸、稀盐酸和稀硝酸作用,但易溶于氢氟酸,其原因可能是
A. 氢氟酸的酸性比其他酸强 B. 氢氟酸的氧化性比其他酸强
C. 氢氟酸的还原性比其他酸强 D. 钛离子易与氟离子形成可溶性难电离物质
二、选择题(本题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
9.下列各组中,两种气体的分子数一定相等的是
A. 温度相同、体积相同的O2和N2 B. 质量相等、密度不等的N2和C2H4
![]() C. 体积相等、密度相等的CO和C2H4 D. 压强相同、体积相同的N2和O2
C. 体积相等、密度相等的CO和C2H4 D. 压强相同、体积相同的N2和O2
10.已知-NH2连在苯环上显碱性,而-NH2连在酰基上( )显中性,下列同分异构体中既显酸性又显碱性的物质是
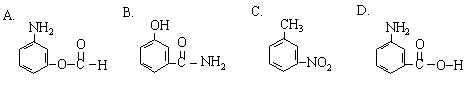 |
11.在有乙离子存在的情况下,欲用试剂丙来检验溶液中是否含有甲离子,下表所加试剂丙能够对甲离子进行成功检验的是
(说明:在实验过程中不允许加热、过滤、萃取等操作)
| 选项 | 试剂丙 | 甲离子 | 乙离子 |
| A. | 稀盐酸、BaCl2溶液 | SO42- | SO32- |
| B. | AgNO3溶液 | Cl- | I- |
| C. | KSCN溶液 | Fe2+ | Fe3+ |
| D. | 稀氨水 | Al3+ | Ag+ |
12.取pH均等于2的盐酸和醋酸各100mL分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是
A. 醋酸与锌反应放出氢气多 B. 盐酸溶液已耗尽
C. 醋酸与锌反应速率大 D. 盐酸和醋酸分别与锌反应的速率一样大
13.下列关于实验现象的描述不正确的是
A. 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B. 用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C. 把铜片插入氯化铁溶液中,在铜片表面出现一层铁
D. 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加大
14.现代建筑的门窗框架常用电解加工成的古铜色硬铝制造。取硬铝样品进行如下实验(每一步试剂均过量),由此可以推知硬铝的组成可能为
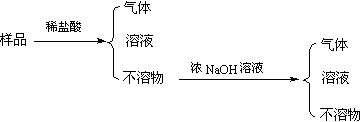
A. Al、Cu、Mg、Si、Mn B. Al、Mg、Si、Zn
C. Al、Fe、C、Cu D. Al、Si、Zn、Na
15.某溶液中含有大量Fe2+、Fe3+、Mg2+和NH4+,其c(H+)=10-2mol·L-1,在该溶液中可以大量存在的阴离子是
A. SO42- B. NO3- C. I- D. CO32-
16.已知HIO既能和酸又能和碱发生中和反应,则它与盐酸反应的产物是
A. IO- B. H2O C. HI D. ICl
三、(本题包括3小题,共16分)
17.(6分)在一定条件下可实现下列物质间的转化,如下图所示:
|
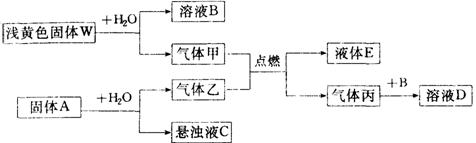
|
(2)工业上曾利用C来制取B,在制取过程中还需加入一种 物质(填该物质的化学式)。
|
18.(6分)有A、B、C、D、E、F六种短周期的主族元素,原子序数依次增大,其中A、D元素的原子最外电子层均只有一个电子,且A和D可形成离子化合物;C、F同主族,B元素位于元素周期表中第二周期,且原子最外层电子数占核外电子总数的3/4,F元素原子最外电子层比同周期的E元素原子的最外电子层多5个电子。
|
|
|
(3)D的氢氧化物和C的氢化物在水溶液中反应的离子方程式为 。
|
|
|
|
|
21.(11分)实验室用稀硝酸与铜反应来制备NO气体,如果采用(Ⅰ)装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不十分理想,因为从观察到的现象不能有力证明反应产物是NO;有人设计了(Ⅱ)装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果。
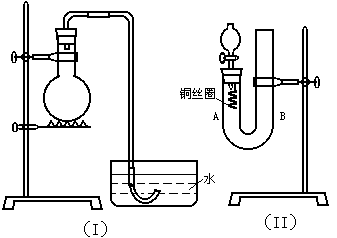 |
|
|
|
①将分液漏斗的活塞打开,从U型管的B侧管口注入稀硝酸,一直注到 为止。
|
|
|
②如果再将分液漏斗的活塞慢慢打开,可立即观察到哪些明显现象?
五、(本题包括2小题,共15分)
|
(1)写出实验室制乙烯的化学反应方程式 。
(2)下表中有左右两栏,左栏中有一项跟右栏中四项相关,把左栏中的这一项和右栏中根本不相关的一项选出。
| 左栏 | 右栏 |
| A.葡萄糖 B.蔗糖 C.淀粉 | ①混合物 ②有甜味 ③没有还原性 ④能发生水解反应 ⑤高分子化合物 |
|
|
答案:左栏 右栏 。
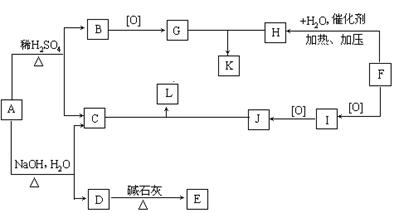 23.(11分)有机物A的结构简式为
23.(11分)有机物A的结构简式为![]() ,从A出发,可发生图示中的一系列反应。其中K的分子式为C12H14O4,L和K互为同分异构体,F的产量可作为衡量一个国家石油化工发展水平的标志。(图中[O]表示氧化)
,从A出发,可发生图示中的一系列反应。其中K的分子式为C12H14O4,L和K互为同分异构体,F的产量可作为衡量一个国家石油化工发展水平的标志。(图中[O]表示氧化)
已知甲苯经氧化可生成苯甲酸:
![]()
请写出:
(1)下列物质的结构简式
|
|
|
|
C+J![]() L
。
L
。
|
六、(每题包括2小题,共14分)
|
|
![]()
|
|
求:(1)30.0mL牛奶中含有多少克氮?
(2)如果蛋白质中氮元素的质量分数为16.8%,则牛奶中含蛋白质的质量分数为多 少?
25.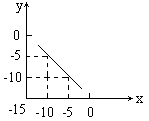 (8分)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y
mol/L。x与y的关系如右图所示;
(8分)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y
mol/L。x与y的关系如右图所示;
(1)求该温度下,中性溶液的pH。
(2)求该温度下0.01mol/L NaOH溶液的pH。
(3)该温度下,pH= a的醋酸溶液与pH= b的NaOH溶液等体积混合,恰好完全反应,求此醋酸溶液中醋酸的电离度。
高考科目教学质量第一次检测
化学试题答题卷
| 题 序 | 一 | 二 | 三 | 四 | 五 | 六 | 总 分 |
| 得 分 |
一、选择题(每小题只有一个选项符合题意,每小题2分,共16分)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答 案 |

二、选择题(每小题有1-2个选项符合题意,每小题3分,共24分)
| 题 号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答 案 |

三、(本题包括3小题,共16分)
17.(6分)
(1) (2)
(3)
18.(6分)
(1) (2)
(3) (4)
19.(4分)(1)( ) (2)( )
 |
四、(本题包括2小题,共15分)
20. ; 。
21. (1) ;
(2)①
②
(3)①
②
 |
五、(本题包括2小题,共15分)。
22.(1)
(2)左栏 右栏 。
23.(1)
B: ;K: ;E: 。
(2)
C+J![]() L
。
L
。
(3)
。
 |
六、(每题包括2小题,共14分)
24.(1) (2)
25.(1)
(2)
(3)
高考科目教学质量第一次检测
化学试题卷 参考答案及评分标准
一、选择题(每小题只有一个选项符合题意,每小题2分,共16分)
1.B 2.A 3.D 4.C 5.B 6.A 7.B 8.D
二、选择题(每小题有1-2个选项符合题意,每小题3分,共24分,每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
9.BC 10.D 11.AD 12.C 13.C 14.A 15.A 16.BD
三、(本题包括3小题,共16分)
17.(1)CaC2 (2分)
(2)Na2CO3 (2分)
(3)Ca(OH)2+2CO2=Ca(HCO3)2 (2分)
18.(1)碱式氯化镁 (1分)
(2)NaOH+HClO4===NaClO4+H2O (2分)
(3)OH-+HF===F-+H2O (2分)
(4)大于 (1分)
19.(1)增大 (2)减小 每空2分,共4分。
四、(本题包括2小题,共15分)
20.湿润的碘化钾淀粉试纸 (2分)
500 mL容量瓶 (2分,若缺“500 mL”只得1分)
21.(1)无; (1分)
由于烧瓶内的空气不易排除,生成的NO很快被氧化成红棕色的NO2,不易观察到有无色的NO生成。 (2分)
(2)①单孔塞下沿与液面间不留有空隙(无气泡存在) (2分)
②铜丝上有气泡产生 (2分)
(3)①当产生的NO气体将稀HNO3排入U型管B侧管内使铜丝网与稀HNO3脱离后反应会立即停止;在U型管A侧管内可观察到无色的NO气体。 (2分)
②U型管的B侧管中的稀HNO3又回落到A侧管内,分液漏斗中有红棕色气体出现。 (2分)
五、(本题包括2小题,共15分)
22.(4分)
|
CH3CH2OH————→CH2=CH2↑+H2O (2分)
(2)C ;② (2分)
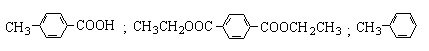 23.(11分)
23.(11分)
(1)
(各2分,共6分)
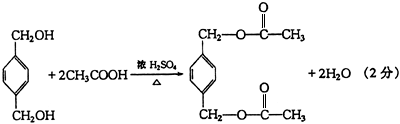 (2)
(2)
(3)
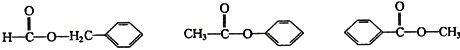 |
(各1分,共3分)
六、(本题包括2小题,共14分)
24解:(1) 0.168 g (3分)
(2) 3.24% (3分)
25解:(1)由图可知c(H+)·c(OH-)=10-15,故c(H+)=10-7.5 mol/L pH=7.5 (2分)
(2)0.01 mol/L NaOH溶液中c(H+)=10-15/10-2=10-13 mol/L pH=-lg10-13=13
(2分)
(2) CH3COOH+NaOH==CH3COONa+H2O
c (CH3COOH)=c(NaOH)=10b-15 mol/L ,c (H+)=10-a mol/L
CH3COOH的电离度== ![]()
(4分)