高三化学单元测试2
一.选择题(下列各小题有1或2个选项符合题意)
1.可逆反应4NH3+5O2==4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速度Vx(表示反应物的消耗速度或生成物的生成速度)( )
A.V(O2)=0.001mol·L—1·S—1 B、V(NO)==0.008 mol·L—1·S—1
C.V(H2O)==0.003 mol·L—1·S—1 D、 V(NH3)==0.002 mol·L—1·S—1CD
2. 对于的反应M+N→P,如果温度每升高10℃,化学反应速度增加了2倍;在10℃时完成某反应的10%需要81min,若将温度升高到30℃,完成该反应的10%需要时间为............................................................ ( )A
A.9min B.27min C.13.5min D.3min
3.在一定温度下,可逆反应A2(g)+B2(g)===2AB(g)达到化学平衡的标志是.............. ( )C
A.容器内的总压强不随时间而变化
B.单位时间内有nmolA2生成的同时就有nmolB2生成
C.单位时间内有nmolA2生成的同时就有2nmolAB生成
|
|
D.单位时间内有nmolB2生成的同时就有nmolAB生成
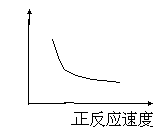
4.对于有气体参加的反应,在右图坐标中纵坐标表示的是( )B
A.温度 B.反应时间
C.反应物浓度 D.压强
5.某湿度下可逆反应N2O4(g)==2NO2-Q,在密闭容器中达到化学平衡,下列说法正确的是 ( )C.
①加压时(体积变小),将使正反应速度增大;②保持体积不变,加入少量的NO2将使正反应速度减小;③保持体积不变,加入少量N2O4,再次达到化学平衡时,体系颜色变深;④保持体积不变,升高温度,再次达到化学平衡时体系颜色变深.
A. ①④ B. ②③④ C. ①③④ D. ①②③④
6.某温度下,可逆反应H2(g)+I2(g)==2HI(g)+Q,在一有活塞的密闭容器中达到化学平衡;下列说法不正确的是 ( )C
A.恒温,压缩体积,化学平衡不移动,颜色加深
B.恒压充入HI(g),开始时正反应速度减小
C.恒容,升高温度正反应速度减小
D.恒容充入氮气,化学平衡不发生移动.
7.下列事实不能用勒沙持列原理解释的是............................................................ ( )B
A.往氢硫酸溶液中加入碱,有利于S2-增多
B.500℃左右比室温更有利于合成氨
C.配制三氯化铁溶液时,向溶液中加入少量盐酸
D.加入催化剂五氧化二钒,能加快二氧化硫转化为三氧化硫的速度
8.1体积SO2和3体积O2混合后,在450℃左右通过五氧化二钒催化剂发生如下可逆反应:2SO2(g)+O2(g)==2SO3(g),若在同温同压下测得反应前后混合气体的密度之比为9:10,则二氧化硫的转化率为............. ( )C
A.20% B.62% C.80% D.95%
9.由于催化作用使反应速率加快的是······························································· ( )
A、 乙酸乙酯水解时加入少量稀硫酸
B、 实验室制取甲烷时,要加入生石灰
C、 苯和液溴反应时,加入少量铁粉
D、锌与盐酸反应,加入少量浓硫酸
|
|
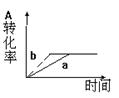
10.已知某可逆反应在密闭容器中进行:A(g)+2B(g) ![]() 2C(g)+D(s)+Q,右图中曲线a代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是
2C(g)+D(s)+Q,右图中曲线a代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是
................................................................................ ( )C
A.增大A的浓度 B.缩小容器的体积
C.加入催化剂 D.升高温度
11、二氧化氮存在下列平衡:2NO2 ==N2O4(g)+Q,在测定NO2 的相对分子质量时,下列条件较为适宜的是..................................................................................................................... ( )
A、温度130℃、压强3.03×105Pa
B、 温度25℃、压强1.01×105Pa
C、温度0℃、压强5.05×104Pa
D、 温度130℃、压强5.05×104Pa
12.在一定条件下,某密闭容器中发生如下可逆反应:2SO2(g)+O2(g)==2SO3(g)+Q;达到化学平衡时,SO2 、O2和SO3的物质的量之比3:2:4。其它条件不变,升高温度达到新的化学平衡时,二氧化硫为1.4mol,O2为0.9mol,则此时SO3的物质的量为.......................................................................................................................... ( )A.
A.1.4mol B.1.6mol C.1.8mol D.2.0mol
13.在一定温度下,将amolPCl5通入一容积不变的容器中达到如下化学平衡:
PCl5(g)==PCl3(g)+Cl2(g);此时平衡气体的压强为P1;再往容器中通入amolPCl5, 恒温下再次达到化学平衡后压强为P2,则 P1与P2的关系是.................................................................................................... ( )B.
A.2 P1 ==P2 B. 2 P1 >P2
C. 2 P1 <P2 D. 2P1 ==2P2
14.将2molSO2和 2molSO3气体混合于固定体积的密闭容器中,在一定条件下发生下列可逆反应: 2SO2(g)+O2(g)==2SO3(g)+Q,平衡时SO3为nmol,相同温度下,分别按下列配比在相同体积的密闭容器中放入起始物质,平衡时SO3的物质的量大于nmol的是( )CD
A. 2molSO2+1molO2 B. 4molSO2+1molO2
C. 2molSO2+1molO2+2molSO3 D. 3molSO2+1molO2+1molSO3
15.工业生产中常采用加压措施的是··································································· ( )
A、2SO2+O2![]() 2SO3 2NO+02
2SO3 2NO+02![]() 2NO2
2NO2
C、N2+3H2![]() 2NH3 C2H4+H2O
2NH3 C2H4+H2O![]() C2H5OH
C2H5OH
16.在某温度下,将2molA和3molB充入一密闭容器中,发生如下可逆反应:aA(g)+B(g)==C(g)+D(g),5min后达到平衡。已知各物质的平衡浓度的关系为:[A][B]==[C][D],若在温度不变的情况下将容器体积扩大为原来的10倍,其A的转化率不变,则B的转化率为................................................................................................. ( )D
A.60% B.24% C.4% D.40%
17.可逆反应A(g)+2B(g)===2C(g)+Q(Q>0)在不同的温度或不同的压强下(P1>P2)下达到化学平衡,混合气体中A的体积分数随温度或压强的变化曲线正确的是......................................................................... ( )D
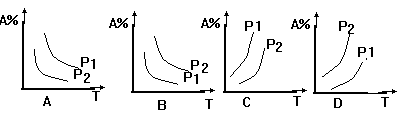
18、反应速度V和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2→2HCl的反应速度V可表示为V=k(CH2)m(CCl2)n,式中k为常数,m、n值或用下表中数据确定之:
| CH2(mol/L) | CCl2(mol/L) | V(mol/L·S) |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 4.0k |
由此可推得,m、n的正确值是...................................................................... ( )D
A、m=1、n=1 B、m=1/2、n=1/2 C、m=1/2、n=1/2 D、m=1、n=1/2
19. 在一密闭容器中,反应A(气)![]() bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.a>b
20、已知反应A+3B![]() 2C+D在某段时间内以A的浓度变化表示的化学反应速率为1 mol·L—1·S—1,则此段时间内以C的浓度变化表示的化学反应速率为( )
2C+D在某段时间内以A的浓度变化表示的化学反应速率为1 mol·L—1·S—1,则此段时间内以C的浓度变化表示的化学反应速率为( )
A.0.5 mol·L—1·S—1 B.1 mol·L—1·S—1
C.2 mol·L—1·S—1 D.3 mol·L—1·S—1
二.填空题: (A)b=3(b)1<c<4 (2)降温
21.牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在如下平衡:

进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会腐蚀,其原因是_____________
____________________________________________________________.
已知Ca5(PO4)3F(固体)的溶解度比上面的矿物的溶解度更小,质地更硬,请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋的原因是:
_____________________________________________________________________.
根据上述原理,请你提出一种其它捉进矿化的方法:________________________________.
22、高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)![]() Fe(S)+CO2(g)-Q
Fe(S)+CO2(g)-Q
其平衡常数可表达为:K==[CO2]/[CO],已知1100℃时K=0.263。
(1)温度升高时,化学平衡移动达到后达到新的平衡,高炉内CO2
和CO的体积比值为——————,平衡常数K值______(本大题空格均选:增大、减小或不变)。
(2)1100℃时测得高炉中[CO2 ]=0.025mol/L,[CO]=0.1mol/L,在这种情况下,该反应是否处于平衡状态_______(填是或否),此时,化学反应方程式应速率是V(正)____V(逆)(填大于、小于或等于),其原因是__________________________________________。
(MCES-98)三.综合题
23.现有一份“将SO2转化为(NH4)2SO4”的资料,摘录如下:
“一个典型实例:初步处理后的废气含0.2%的二氧化硫和10%的氧气(体积分数)。在400℃时废气以5m3·h-1的速率通过五氧化二钒催化剂层与20L·h-1的速率的氨气混合,再喷水,此时气体温度由400℃降至200℃,在热的结晶装置中得到硫酸铵晶体”(气体均已拆算为标准状况)。
利用上述资料,用氨来除去废气中的二氧化硫,回答下列问题:
(1)按反应中的理论值,二氧化硫和氧气的物质的量之比为2﹕1,该资料中这个比值是______,简述不采用2﹕1的理由__________________
(2)通过计算,说明为什么废气以5m3·h-1速率与20L·h-1的速率氨气混合?
(3)若某厂每天排放1×104m3这种废气,按上述方法该厂每月(按30天)可得硫酸铵多少吨?消耗氨气多少吨?
化学反应速度、化学平衡
1CD、2A、3C、4B、5C、6C、7B、8C、9AC、10C、11D、12A、13B、14CD、15CD、16D、17D、18D、19、AC、20、C;21(1)H++OH—→H2O;平衡向脱矿方向移动。5Ca2++3PO43—+F—→Ca5(PO4)3F、多吃含钙食物。22、(1)增大、增大、(2)否、大于、(3)略;
23、(1)1﹕50,根据勒沙特列原理,过量而廉价的氧气可提高二氧化硫的转化率。(2)废气中每小时排放SO2的体积为1000×5×0.2%=10L,每小时氨气与废气中SO2混合的体积比为2﹕1,恰好与反应中生成(NH4)2SO4的物质的量一致。(3)3.54t硫酸铵,0.91t氨气