高三化学单元测试试卷
第Ⅰ卷(选择题 共50分)
本试卷分为第1卷(选择题)第Ⅱ卷(非选择题两部分)共100分,考试时间90分钟
相对原子质量H1 C 12 0 16 Ca 40 Na 23
第六章——氧族元素(高一内容)
一、选择题(本题包括10小题,每小题2分,共20分)
1.下列化合物中,通常能由该化合物的两种元素的单质直接化合成的是
A.FeS B.S03
C.H2Te D.FeCl2
2.对S02和S03的说法错误的是
A.都是酸酐
B.都能与水化合生成相应的酸
C.都能与碱溶液反应生成盐和水
D.通常条件下都是气体
3.下列气体中既有氧化性又有还原性的是
A.SO2
B.H2S
C.C02
D.S03(气)
4.2000年4月我国部分省市遭到沙尘暴的袭击,如此多的风沙有气候的原因,更有沙漠化的原因。欲从根本上解决沙漠化的问题,则应
A.减少工业“三废”的排放
B.人为改良土地酸碱性
C.大力植树造林,建造绿色屏障
D.尽量减少物质燃烧时产生的粒状飘浮物
5.使用浓硫酸时,若不慎沾在皮肤上,正确的清洗方法是
A.用饱和的氢氧化钠溶液中和
B.用大量水冲洗,然后用3%—5%碳酸氢钠溶液清洗,并涂上碳酸氢钠溶液
C.用于布擦,然后用水冲洗。
D.用稀氨水冲洗
6.工业上以含硒的的废料中提取硒方法之一是用H2S04和NaN03处理废料,获得亚硒酸和少量硒酸,加入盐酸共热,硒酸被转化为亚硒酸2HCl+H2Se04=H2Se03+Cl2↑+H20再将S02通入亚硒酸溶液中,即析出单质硒。则下列叙述正确的是
A.H2Se04氧化性比Cl2弱
B.HeSe03的还原性比S02强
C.析出1molSe,需H2Se03、S02、H20各1mol
D.H2Se03的氧化性比H2S03强
7.环境污染已成为人类社会面临的重大威胁,各种污染数不胜数。下列名词与环境污染无关的是①水华;②酸雨;③光化学污染;④水俣病;⑤潮汐;⑥臭氧空洞;⑦赤潮;⑧温室效应;⑨大脖子病
A.⑤⑨ B.⑦⑨
C.④⑤⑨ D.⑤⑥⑦
8.把硫和强碱(如NaOH)加热至沸,反应后,硫转化为S2-和SO32-则反应的S和生成的S2-、SO32-的物质的量之比为
A.2:1:1
B.3:2:1
C.3:1:2
D.4:1:3
9.环保系统每天通过新闻媒体向社会公布城市空气质量,是以污染浓度来确定空气质量标准的,这些污染物一般是指
A.二氧化硫、氮氧化物、二氧化碳、碳氢化合物
B.二氧化硫、氮氧化物、一氧化碳、悬浮微粒
C.稀有气体、氮氧化物、一氧化碳、悬浮微粒
D.稀有气体、氮氧化物、二氧化碳、悬浮微粒
10.S02是常见的大气污染物之一,我国规定空气中S02含量不得超过0.02mg·L-1。下列措施中不能够减少S02排放量的是
A.用天然气代替煤炭做民用燃料
B.提高热能利用率
C.硫酸厂采取措施提高尾气的吸收率
D.燃煤中加入生石灰后使用
二、选择题(本题包括10小题,每小题3分,共30分)
11.根据2H2S十O2=2H20+2S所得下列结论正确的是
A.O2比S更稳定
B.H2S比H20酸性强
C.H20比H2S更稳定
D.O比S非金属性强
12,将m克铜与足量的浓硫酸共热并完全反应,在标准状况能生成nL气体体,则被还原的硫酸为
A.m/64mol B.m/32mol
C.64n/22.4g D.98n/22.4g
3.浓H2S04与下列物质反应时,既表现氧化性,又表现了酸性的是
A.红热的木炭 B.H2S气体
C.单质铜 D.FeO
14.工业上常用的铁屑跟,硫酸反应并经除杂、浓缩、结晶、干燥等过程,来制取绿矾晶体,为制得较纯净的绿矾晶体,合理的方法是
A.使硫酸过量 B.使铁屑过量
C.使用稀硫酸 D.使用浓硫酸
15.下列物质均有漂白作用,但其中一种的漂白原理与其它三种不同,它是
A.HCl0 B.S02
C.03 D.Na202
16.将甲、乙、丙三瓶含等量H2S04的不同浓度的溶液,分别做如下处理:甲瓶加水稀释,乙瓶加少许BaCl2溶液,丙瓶加入过量Ba(N03)2溶液,然后用等浓度的NaOH溶液分别与之完全反应,所耗NaOH溶液的体积为
A.甲=丙>乙 B.丙>乙>甲
C.乙>丙>甲 D.甲=乙=丙
17.下列各种气体,不能用浓H2S04干燥的是:①Cl2②H2③CO④HCl⑤02⑥H2S⑦NH3
A.②③⑥⑦ B.②③④⑥⑦
C.②⑥⑦ D.⑥⑦
18.有反应2FeS04=Fe203+S02↑+S03↑将生成的混合气体通入
BaCl2溶液中生成的沉淀是
A.Ba(HS03)2 B.BaS03
C.BaS04 D.BaS03和BaS04
19.你认为减小酸雨产生的途径,可采取的措施是
①少用煤作燃料,②把工厂烟囱造高,③燃料脱硫,④在已酸化的土壤中加石灰,⑤开发新能源
A.①②③ B.②③④⑤
C.①③⑤ D.①③④⑤
20.密度为1.4g/cm3的稀硫酸溶液中,逐滴加入BaCl2溶液,直至沉淀完全为止,已知沉淀的质量与硫酸溶液质量恰好相等,则原硫酸的浓度为
A.29.6% B.42.1%
C.14.81m01·L-1 D.6.02mol·L-1
第Ⅱ卷(非选择题 共50分)
三、实验题(共14分)
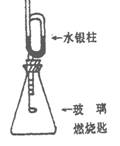 21.(4分)如图装配好装置,待内外空气压强不变时标注出水银液面的刻度(用红漆),取下橡皮塞,在玻璃燃烧匙中加入硫粉,用酒精灯点燃迅速移入锥形瓶中并塞紧橡皮塞。硫粉安静地燃烧,水银柱推向左管。当火焰熄灭后,静置,水银柱又慢慢回到原标定的刻度。简要回答下列问题
21.(4分)如图装配好装置,待内外空气压强不变时标注出水银液面的刻度(用红漆),取下橡皮塞,在玻璃燃烧匙中加入硫粉,用酒精灯点燃迅速移入锥形瓶中并塞紧橡皮塞。硫粉安静地燃烧,水银柱推向左管。当火焰熄灭后,静置,水银柱又慢慢回到原标定的刻度。简要回答下列问题
(1)水银柱推向左管说明什么?
(2)硫粉未燃尽时火焰就熄灭了,说明:
(3)根据水银柱最后又回到原先标定的刻度,可得到什么结论?
(4)根据反应方程式S+O2S02和上述结论又可推导出什么(或证明什么)?
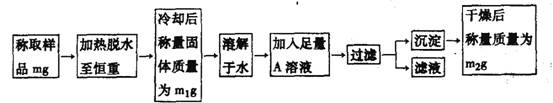
22.(10分)要同时测定混有少量氯化钠杂质的芒硝(Na2SO4·nH20)的纯度和结晶水的含量,按下列流程进行实验:
(1)加热脱水时,若有固体飞溅出来造成损失,则会使测得的结晶水的含量偏______________。加热脱水后,若将样品露置于空气中冷却,则会使测得的结晶水的含量偏_____________
(2)现有硝酸银、氯化钡、氯化钙、硝酸钡、氢氧化钡五种溶液,从测定的准确性考虑,可作为A溶液的分别是_____________。若加入A溶液的量不足,会使测得的纯度偏_____________。判断A溶液是否足量的方法是_____________
(3)过滤时,应把滤纸上的沉淀洗涤干净,洗涤沉淀的方法是__________________________若不洗涤,会使测得的纯度偏_____________
(4)通过实验,测得芒硝化学式中n值为10,则芒硝的纯度为____________%
四.填空题(共10分)
23.(5分)过氧化氢(H202)俗称双氧水,它是一种液体,易分解为水和氧气,常用作氧化剂、漂白剂和消毒剂。为了贮存、运输、使用的方便,工业上采用“醇析法”将H202转化成固态的过碳酸钠晶体(其化学式为2Na2C03·3H202)。该晶体具有Na2C03和H202的双重性质。“醇析法”的生产工艺过程如下:在0-5℃下,往饱和的Na2C03溶液中先后加H202、稳定剂(MgCl2和Na2Si03)和异丙醇,经充分反应,过滤分离,即得过碳酸钠晶体。
(1)固化H202采用Na2C03作载体的理由是__________________________
(2)反应控制在0~5℃下进行的原因是__________________________
(3)稳定剂能反应生成不溶物将过碳酸钠粒子包裹住,该反应的化学方程式为:__________________________
(4)下列物质不会使过碳酸钠失效的是_____________
A.Mn02 B.H2S
C.CH3COOH D.NaHC03
(5)加入异丙醇的作用是_____________。
24.(5分)已知:氢氧化钙在水中存在下列溶解平衡 Ca(OH)2(固) Ca2++20H-在火力发电厂燃烧煤的废气中往往含有S02、O2、N2、C02等。为了除去有害气体S02并变废为宝,常常用粉末状的碳酸钙或熟石灰悬浊液洗涤废气,反应产物为石膏。
(1)写出上述两个反应的化学方程式:__________________________
①S02与CaC03悬浊液反应:__________________________
②S02与Ca(OH)2悬浊液反应:__________________________
(2)试说明用熟石灰的悬浊液,而不用澄清石灰水洗涤废气的理由:
__________________________
(3)在英国进行的一个研究结果表明:高烟囱可以有效地降低地面S02浓度。在20世纪的60~70年代的10年间,由发电厂排放出的S02增加了35%,但由于建造高烟囱的结果,地面浓度降低了30%之多。请你从全球环境保护的角度,分析这种方法是否可取?并简述其理由
五.推断题(共11分)
25.(4分)有A、B、C、D四瓶未知溶液,它们是Na2C03,K2S04,KHS04和Ba(N03)2,为了鉴别它们,进行如下实验:由此推断
A_____________,B_____________。C_____________,D_____________。
26.(7分)已知A-N为不同物质的代号,其中A、J为固体单质。F为焰色反应呈黄色的固体化合物,从A开始可发生以下一系列变化:
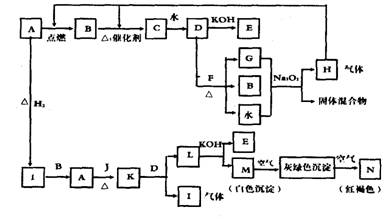
试回答:
(1)写出下列物质的化学式:
A____________B___________C___________D___________E___________
(2)写出有关反应的化学方程式:
D和F反应______________________ 由M生成N______________________
六.计算题(共15分)
27.在Fe与Fe203组成的混合物15g中,加入稀H2S04150mL,放出H2 1.68L(标准状况)。当反应停止时Fe与Fe203均无剩。且溶液中无Fe3+存在。为了中和溶液中过量的H2S04,并使Fe2+完全成Fe(OH)2沉淀,共用去了物质的量浓度为3mol/L的NaOH溶液200ml 。试计算所用H2S04溶液的物质的量浓度。
28(10分)某化工厂每小时生产98%(质量分数)硫酸at,为使硫燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中含氧气的体积分数为b%。若空气中氧化的体积分数为21%,且不考虑各生产阶段的物料损失,则:
①该厂每小时消耗标准状况下空气的体积为___________m3
②满足题设要求,b%的下限等于___________________________