高三化学氮族知识总结(五)
教学内容
1.归纳氮元素、磷元素及其化合物间的转化.
2.几种重要物质的制取、检验及比较
3.掌握四种主要规律的应用
规律、重点剖析及典型例析
(一)掌握知识网络
1.氮元素及其化合物间的转化
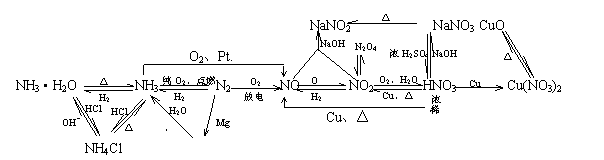
(二)用比较法区分相关物质
1.比较白磷和红磷
| 白(黄)磷 | 红(赤)磷 | ||
| 组 成 | P4 | Px(x>4) | |
|
结 构 | 结构更复杂 | ||
| 颜 色 | 淡黄 | 暗红 | |
| 状 态 | 蜡状、质脆、固体 | 粉末状固体 | |
| 气 味 | 大蒜般的臭味 | 无臭 | |
| 水溶性 | 不溶 | 不溶 | |
| CS2中溶解性 | 易溶 | 不溶 | |
| 着火点 | 40℃(易自燃) | 240℃ | |
| 毒 性 | 剧毒 | 无毒 | |
|
| 用于制高纯度H3PO4、 制烟幕弹和燃烧弹 | 用于制农药及 安全火柴 | |
| 相互转变 | |||
| 保 存 | 水封密闭 | 密 封 | |
2.NO、NO2、N2O4的性质及转化
| NO | NO2 | N2O4 | |||||||||
| 颜色 | 无色 | 红棕色 | 无色 | ||||||||
| 毒性 | 有 | 有 | 有 | ||||||||
| 水溶性 | 难 | 易且反应 | 随NO2与H2O反应,平衡不断移动 | ||||||||
| 与O2是否共存 | 否 | 能 | 能 | ||||||||
|
相互转化 |
| ||||||||||
(三)抓住典型物质的结构、性质、用途、制取等内在关系
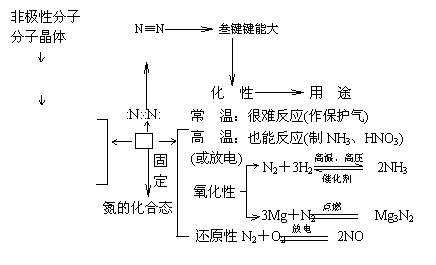 1.氮气
1.氮气
物 性
![]() 难溶于水
难溶于水
熔沸点很低 N2
无色无气味
气体
2.氨的结构和性质
|
| 分子式 | 电子式 | 结构式 | ||
|
|
|
| H H H | ||
| 特点 | -3价为N最低价 | 有孤对电子 | 极性分子(三角锥形) | ||
|
| 有还原性 | 与H+等形成配位键 | 极易溶于水(1:700) | ||
|
| 4NH3+5O2 4NO+6H2O 4NH3+3O2 2N2+6H2O 2NH3+3Cl2 = N2+6HCl | NH3+H+=NH4+ NH3+HCl=NH4Cl | NH3+H2O NH3·H2O NH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
易挥发
|
|
|
|
(四)重要物质的制法(反应原理)
|
| 实 验 室 制 法 | 工 业 制 法 | ||||||
|
| 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O | N2+3H2 2NH3
| ||||||
| NO | 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O | 4NH3+5O2 4NO+6H2O | ||||||
| NO2 | Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O | 2NO+O2=2NO2 | ||||||
|
| NH3→NO→NO2 3NO2+H2O=2HNO3+NO | |||||||
|
| Ca3(PO4)2+3H2SO4 2H3PO4+3CaSO4 | |||||||
| 普 钙 (过磷酸钙) | Ca3(PO4)2+2H2SO4=Ca(H2PO4)2+2CaSO4 | |||||||
| 重 钙 | Ca3(PO4)2+4H3PO4=3Ca(H2PO4)2 |
注意
1.NH3的干燥剂选用
① 氨是碱性气体(有水),故不能用酸性干燥剂.如浓H2SO4、P2O5等
② 氨与CaCl2反应生成CaCl2·8NH3.故也不能用无水CaCl2
③ 氨只能用碱性干燥剂如碱石灰
2.氨催化氧化法制HNO3有关事项
(1)为提高原料转化率,应补充空气,多次氧化和吸收
(2)尾气吸收——用碱液
NO+NO2+2NaOH=2NaNO2+H2O
2NO2+2NaOH=NaNO3+NaNO2+H2O
当n![]() :n
:n![]() ≥1.均可被吸收完全
≥1.均可被吸收完全
(3)硝酸浓度的提高
|
|
(五)六种物质的检验
| 物 质 | 试剂及主要现象 | 反应原理 | |||||||
|
NH3 | 湿红石蕊 试 纸 | 变 蓝 | NH3+H2O NH3·H2O NH4++OH- | ||||||
| 浓盐酸 | 白 烟 | NH3+HCl=NH4Cl | |||||||
| NH | NaOH(△) | 有气体放出 | NH | ||||||
|
| 无色变 红棕色 |
| |||||||
|
| AgNO3溶液 | 无 沉 淀 | 3NO2+H2O=2HNO3+NO | ||||||
|
NO | 铜片、 浓H2SO4 (共热) | 2NO | |||||||
(六)重要规律
1.铵盐分解规律
|
|
|
|
① 稳定易挥发酸成的铵盐 NH3↑+酸的挥发性物质
如 NH4Cl(s) NH3↑+HCl↑ 类似的有 NH4F
|
“假升华” 能否类推 NH4I?
区别 I2(s) I2(g)
![]() ② 稳定难挥发酸成的铵盐 NH3↑+酸
② 稳定难挥发酸成的铵盐 NH3↑+酸
![]() 如 (NH4)2SO4 2NH3↑+H2SO4
如 (NH4)2SO4 2NH3↑+H2SO4
![]() ③ 不稳定且无强氧化性酸成的铵盐 NH3↑+酸的分解产物
③ 不稳定且无强氧化性酸成的铵盐 NH3↑+酸的分解产物
![]() 如 (NH4)2CO3 2NH3↑+H2O+CO2↑
如 (NH4)2CO3 2NH3↑+H2O+CO2↑
NH4HCO3 NH3↑+H2O+CO2↑
![]() NH4I NH3↑+I2↑+H2↑
NH4I NH3↑+I2↑+H2↑
(有色)
④ 由不稳定且有强氧化性酸(HNO3)成的盐
|
 一般发生氧化还原反应
一般发生氧化还原反应
温度不同,产物不同
![]() 低温,可得NH3+HNO3
低温,可得NH3+HNO3
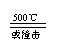 如 5NH4NO3 2HNO3+4N2↑+9H2O
如 5NH4NO3 2HNO3+4N2↑+9H2O
![]() 2NH4NO3 2N2↑+O2↑+4H2O+Cl
2NH4NO3 2N2↑+O2↑+4H2O+Cl
|
![]() 易爆物 注意妥善保存,勿研磨、勿撞击.
易爆物 注意妥善保存,勿研磨、勿撞击.
2.磷酸盐的溶解性规律
① 磷酸二氢盐一般都易溶于水
② 磷酸一氢盐和磷酸正盐大多难溶于水(除K+、Na+、NH4+等)
③ 同种阳离子所形成的三种盐的溶解性大小(同温):磷酸二氢盐>磷酸一氢盐>磷
酸正盐
如 NaH2PO4>Na2HPO4>Na3PO4
Ca(H2PO4)2>CaHPO4>Ca3(PO4)2
![]()
![]() 联系:制磷肥的主要目的:
联系:制磷肥的主要目的:
难溶于水 易溶于水 植物吸收
磷矿石 +(H2SO4) 磷酸二氢钙
[Ca3(PO4)2] 或H3PO4 Ca(H2PO4)2
巩 固 练 习
(一)选择
1.一定条件下在过量氧气中充分氧化1摩(指一步氧化)下列气体时,失去电子的物质的
量最大的是 ( )
(A)NH3 (B)NO (C)H2S (D)CO
2.下列不具备剧毒作用的物质是 ( )
(A)HF (B)P4 (C)H3PO4 (D)HPO3
3.对下列各组物质性质的递变叙述正确的是 ( )
(A)稳定性: NH3>PH3>ASH3
(B)氧化性: 浓H3PO4>浓H2SO4>浓HNO3
(C)酸性(相同浓度): HClO4>HNO3>H2SO3
(D)熔点由低到高的顺序为: NH3、H2O、HF
4.下列所得物质不属于混和物的是 ( )
(A)镁条在空气中完全燃烧后的生成物.
(B)用浓NHO3与Cu片反应,收集得到的二氧化氮气体.
(C)1摩H3PO4与1.2摩Ca(OH)2反应生成的盐。
(D)2摩H3PO4与1摩Ca(OH)2反应生成的盐。
5.将体积相同的试管,分别装满等体积混合的下列各组气体,倒立于水中则进入试管
的水最多的是 ( )
(A)CO2、O2 (B)NO2、O2 (C)NO、NO2 (D)NH3、O2
6.有关铵盐性质叙述中,错误的是 ( )
(A)铵盐可与碱反应,加热放出氨气
(B)铵盐加热时,均可收集到氨气
(C)铵盐的水溶液均显碱性
(D)铵盐均可溶于水.
|
![]() (A)无色盐的试液
放出能使湿润的红色石蕊试纸变兰的气体.
(A)无色盐的试液
放出能使湿润的红色石蕊试纸变兰的气体.
|
![]() (B)无色试液
试液变红.
(B)无色试液
试液变红.
|
![]() (C)在产生黄色沉淀的试管中
沉淀溶解.
(C)在产生黄色沉淀的试管中
沉淀溶解.
|
![]() (D)无色试液
反应中产生的沉淀不能被酸溶解.
(D)无色试液
反应中产生的沉淀不能被酸溶解.
结论:说明无色试液不可能是铝盐溶液
8.用以下三种途径来制取相等质量的硝酸铜:
(1)铜跟浓硝酸反应
(2)铜跟稀硝酸反应
(3)铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应
以下叙述正确的是 ( )
A.三种途径所消耗的铜的物质的量相等
B.三种途径所消耗的消酸的物质的量相等
C.所消耗的铜的物质的量是: 途径(3)>途径(1)>途径(2)
D.所消耗的硝酸的物质的量是: 途径(1)>途径(2)>途径(3)
9.a、b、c、d、e五种无色气体中,进行如下实验:
实验步聚 实验现象
① a、b相混合 气体变成棕色
② c、d相混合 产生白烟
③ a、e分别通入少量溴水中 溴水均成无色透明溶液
④ b、e分别通入氢硫酸中 都产生淡黄色的沉淀
则a、b、c、d、e可能依次是 ( )
A.O2、NO、HCl、NH3、CO2 B.O2、NO、NH3、HCl、SO2
C.NO、O2、NH3、HCl、SO2 D.HBr、Cl2、NH3、H2S、C2H4
10.室温时,两个容积相等的集气瓶分别盛有M和N两种气体(同温同压),然后将两
瓶口相对,抽去玻片,充分混合,容器内的压强由大到小的顺序是 ( )
| 编 号 | ① | ② | ③ | ④ |
| 气体M | H2S | H2 | NH3 | NO |
| 气体N | SO2 | Cl2 | HCl | O2 |
A. ①②③④ B. ②④①③
C. ④①②③ D. ①④③②
(二)填空
11.有A、B、C、D、E、F六瓶无色溶液,它们分别是NaCl、K3PO4、NH4NO3、Ca(NO3)2、
MgCl2和BaCl2.现取样进行如下实验:
(1)分别滴入硝酸银溶液,在A、B、D、E溶液中出现沉淀;
(2)分别滴入碳酸钠溶液,在C、D、E溶液中出现沉淀;
(3)将C溶液滴入其它五种溶液中,只有A溶液中出现沉淀;
(4)将NaOH溶液分别滴入D、E溶液,只有E溶液出现沉淀。
根据以下实验现象可判断A是(写分子式,下同)______、B为_______、C为_____
D为________、E为_______、F为__________.
12.在10mL 0.1mol/L的H3PO4溶液中,逐滴入0.05mol/L的Ba(OH)2溶液,当加至____mL
时,再滴入Ba(OH)2溶液即开始出现沉淀.
13.现有一定量含NO2和NO的硝酸工业尾气(不含其它气体),用过量NaOH溶液吸收,
其主要原理可表示如下:
2NO2+2NaOH=NaNO2+NaNO3+H2O
NO2+NO+2NaOH=2NaNO2+H2O
若吸收后溶液中NaNO3和NaNO2的物质的量之比恰好与原尾气中NO和NO2的物
质的量之比相等,若用NOx表示该尾气中氮的氧化物的平均组成,则x值为______.
14.将盛有24mL NO、NO2混合气体的试管倒置于水中,待液面上升至位置不再改变时,
试管内总体体积缩小一半.
(1)原混合气中,NO和NO2体积比为________.
(2)若在剩余气体中通入3mL O2,则又有____ mL 溶液进入试管.
(3)若在原24mL混合气体中通入_____ mL O2,并倒置于水中,溶液将充满整个试管.
答 案
(一)1.A 2.C 3.AC 4.D 5.B 6.BC 7.AC 8.AD 9.C 10.B
(二)11.A-K3PO4 B-NaCl C-Ca(NO3)2
D-BaCl2 E-MgCl2 F-NH4NO3
12.10
13.![]()
14.(1)1:3 (2)4 (3)9
 用 途
用 途