高三化学第一节 《镁和铝》练习题
1、镁粉在烟火、闪光粉、鞭炮中是不可缺少得原料。工业上制造镁粉是将镁蒸起在某种气体中冷却。下列可作为冷却气体的是( )
①空气 ②CO2 ③Ar ④H2 ⑤N2
A. ①② B. ②③ C.③④ D.④⑤
【答案】C
2、铝和铍的性质相似,下列关于铍的性质推断正确的是( )
A. Be能与强碱溶液反应 B.Be(OH)2可溶于水
C. BeCl2溶液能导电 D.氧化铍的化学式为Be2O3
【答案】AC
3、常温下跟镁粉、溴水、臭氧、硝酸都能发生氧化还原反应的是( )
A.H2S溶液 B.K2SO3溶液 C.NH4I溶液 D.NaOH溶液
【答案】AC
4、(93全国)向某溶液中加入过量盐酸生成白色沉淀;过滤后向滤液中加入过量氨水(使溶液呈碱性)又有白色沉淀生成;再过滤后向滤液中加入碳酸钠溶液,又有白色沉淀生成。原溶液中含有的离子可能是:
A. Ag+、Cu2+、Ba2+ B.Ag+、Ba2+、Al3+
C、Ag+、Al3+、Ca2+ D.Al3+、Mg2+、K+
【答案】BC
5、(96上海)下列各组溶液,只要用试管和胶头滴管,不用任何试剂就可以鉴别的是( )
A. KOH和Al2(SO4)3 B.稀H2SO4和NaHCO3
C.CaCl2和Na2CO3 D.Ba(OH)2和NaHSO4
【答案】A
6、(96上海)下列离子方程式书写正确的是
A. 氯化铁溶液中通入硫化氢气体
2Fe3++S2-=2Fe2++S↓
B. 碳酸钡中加入稀硫酸
BaCO3+2H+=Ba2++CO2↑+H2O
C. 偏铝酸钠溶液中加入过量盐酸
AlO2-+4H+=Al3++2H2O
D. 碳酸氢钠溶液中加入过量氢氧化钠溶液
HCO3-+OH-=CO32-+H2O
【答案】C
7.(2003年全国理综卷)下列反应的离子方程式正确的是( )
A. 铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑
B. 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
C. 碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
铜片跟稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O
[答案] C
8、(93全国)下列各组离子:(1)I-、ClO-、NO3-、H+(2)K+、NH4+、HCO3-、OH-(3)SO32-、SO42-、Cl-、OH-(4)Fe3+、Cu2+、SO42+、Cl-(5)H+、K+、AlO2-、HSO3-(6)Ca2+、Na+、SO42-、CO32-,在水溶液中能大量共存的是( )
A.(1)(6) B.(3)(4) C.(2)(5) D.(1)(4)
【答案】B
9.(2003广东卷)在允许加热的条件下,只用一中试剂就可以鉴别硫酸铵、氯化钾、氯化镁、和硫酸铁溶液。这种试剂是( )
A. NaOH B. NH3·H2O C. AgNO3 D. BaCl2
[答案]A
10.(2003广东卷)若溶液中由水电离产生的[OH-]=1×10-14/L,满足此条件的溶液中一定可以大量共存的离子组是( )
A. Al3+、Na+、NO3-、Cl- B.K+、Na+、Cl-、NO3-
C.K+、Na+、Cl-、AlO2- D.K+、NH4+、SO42-、NO3-
[答案] B
11、下列物质能跟镁反应并生成氢气的是( )
A. 甲酸溶液 B.氢氧化钠溶液 C.氯化铵溶液 D.碳酸钠溶液
【答案】AC
12、下列金属中,不能用铝热法制备的是( )
(1) 铬 (2)铁 (3)钒 (4)镁 (5)锰 (6)钠
A.(4)(6) B.(3)(5) C.(1)(2)(3) D.(1)(2)(3)(5)
【答案】A
13、由镁、锌、铁、铝四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是( )
A.锌 B.铁 C.铝 D.镁
【答案】C
14、甲、乙两烧杯中各盛放有100ml3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为( )
A.5.4g B.3.6g C.2.7g D.1.8g
【答案】A
15、(98上海)第二主族元素R的单质及其相应氧化物的混合物12g,加足量水经完全反应后蒸干,得固体16g,试推测该元素可能为()
A. MgB.CaC.SrD.Ba
【答案】BC
16、有镁铝混合粉末12g,将它溶于500mL4mol/L盐酸里,若要使沉淀质量达到最大值,则需要加入2mol/L氢氧化钠溶液的体积为( )
A.1000ml B.500ml C.100ml D.1500ml
【答案】A
17、有100ml3mol/L的氢氧化钠溶液和100ml1mol/L的氯化铝溶液。(1)若将氢氧化钠溶液分多次加到氯化铝溶液中(边加边搅拌)。(2)若将氯化铝溶液分多次加到氢氧化钠溶液中(边加边搅拌)。
上述整个过程现象与最后生成的Al(OH)3沉淀符合下列说法中的( )
A.现象相同,沉淀量相等 B.现象不同,沉淀量相等
C.现象相同,沉淀量不等 D.现象不同,沉淀量不等
【答案】B
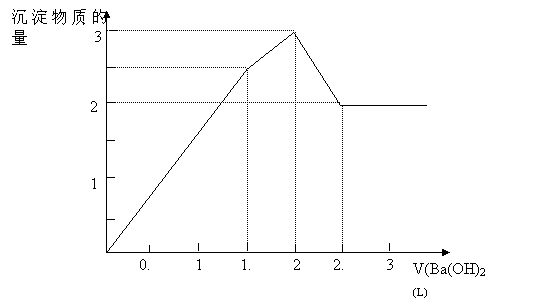
 18、如图所示,向MgCl2和AlCl3混合溶液中加入a或b时,沉淀的物质的量与加入a或b的体积的关系图为:
18、如图所示,向MgCl2和AlCl3混合溶液中加入a或b时,沉淀的物质的量与加入a或b的体积的关系图为:
以下结论不正确的是:
A. 混合液中C(AlCl3):C(MgCl2)=1:1
B. C(AlCl3):C(MgCl2)=3:1
C. t之前加NaOH溶液,t之后加盐酸
D. 盐酸与NaOH溶液的物质的量浓度相同
【答案】B
19、哥伦比亚号航天飞机曾用金属铝粉和高氯酸氨混合物作为固体燃料。加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解。m mol高氯酸氨分解时除产生2m mol水蒸气和m mol氧气外,其他组成元素均以单质气体形式放出,因而产生巨大的推动力。试写出其中涉及的化学方程式:
(1)
(2)
根据此反应原理,1mol高氯酸氨分解所产生的气体有 mol。
![]() 【答案】(1)4Al+3O2=2Al2O3
【答案】(1)4Al+3O2=2Al2O3
![]() (2)2NH4ClO4=4H2O↑+2O2↑+N2↑+Cl2↑ 4mol
(2)2NH4ClO4=4H2O↑+2O2↑+N2↑+Cl2↑ 4mol
20、某课外活动小组做如下实验:往一铝制易拉罐内充满CO2,然后往罐内注入足量的NaOH溶液,立即用胶布严封罐口,过一段时间后,他们发现罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起,解释上述变化的实验现象。
(1)罐壁内凹而瘪的原因是 ,
反应方程式是 。
(2)罐壁再鼓起来的原因是 ,
有关的化学方程式是 。
(3)如果用金属薄铁易拉罐做上述实验出现的结果是
。
【答案】(1)氢氧化钠溶液吸收CO2,罐内压强减小,外界大气压将罐压瘪,CO2+2OH-=CO32-+H2O
(2)Al片表面氧化膜先与碱作用,无气体产生,而后铝与碱溶液作用放出气体,所以又鼓起。Al2O3+2H2O+2OH-=2AlO2-+3H2↑
只是内凹而瘪,不再鼓起。
21、点燃的镁条在SO2中象在CO2中那样继续燃烧,而且反应比镁和CO2反应更为剧烈。反应结束后在盛SO2的广口瓶中可能存在的生成物的化学式是 ,反应的化学方程式是
|
![]() 【答案】Mg MgS 2Mg+SO2=2MgO+S Mg+S = MgS
【答案】Mg MgS 2Mg+SO2=2MgO+S Mg+S = MgS
22、某混合物A中含有KAl(SO4)2、Al2O3和Fe2O3,,在一定条件下可实现下图所示的物质之间的变化:
 |
据此判断:
(1) 固体B所含物质的化学式为
(2) 固体E所含物质的化学式为
(3) 反应①的离子方程式为
【答案】(1)Al2O3 (2)K2SO4 (NH4)2SO4
(3)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
23、今有碱金属的两种碳酸盐和碱土金属(第二主族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量盐酸完全反应,放出CO2体积为1.344L(标准状况),另取等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g。
(1)
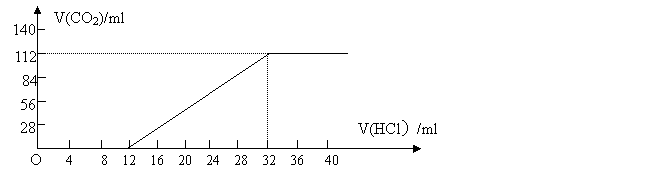 取过滤后滤液的1/10体积,向其中缓慢滴加浓度为0.2500mol/L盐酸,并同时记录放出的CO2体积(标准状况)和消耗盐酸的体积,得到如下图所示的曲线。
取过滤后滤液的1/10体积,向其中缓慢滴加浓度为0.2500mol/L盐酸,并同时记录放出的CO2体积(标准状况)和消耗盐酸的体积,得到如下图所示的曲线。
试计算确定这两种碱金属碳酸盐的化学式。
(2) 将过滤出的不溶性盐投入到浓度为2.500mol/L的盐酸中,当完全反应时,耗去盐酸10.O0ml,试计算确定原不溶性碳酸盐的化学式。
【答案】(1)K2CO3 KHCO3 (2)Mg2(OH)2CO3
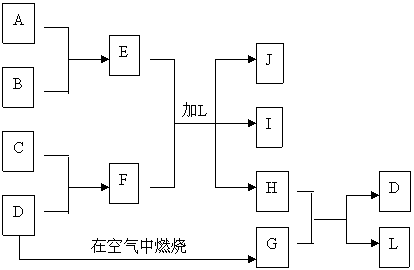 24.图中每一方框中的字母代表一种反应物或生成物。
24.图中每一方框中的字母代表一种反应物或生成物。
产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
(1) L的化学式为:
(2) F的化学式为:
(3) 写出J受热分解反应的化学方程式:
(4) H和G之间反应的化学方程式为:
[答案](1)H2O (2)Na2S
![]() (3)2Al(OH)3= Al2O3+3H2O
(3)2Al(OH)3= Al2O3+3H2O
(5) H2S+SO2=3S+2H2O
25.将等物质的量的两种氧化物溶于100ml硫酸,然后逐滴加入1mol/L的NaOH溶液。当加入的NaOH的体积V1=50ml时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加。当NaOH的体积V2=650ml时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小。当V3≥750ml时,沉淀量不再改变。
(1) 最初加入的50mlNaOH溶液的作用是什么?
(2) 计算所用硫酸的浓度。
(3) 试判断两种氧化物各是什么?并计算其物质的量。
【答案】(1)中和过量酸(2)当沉淀量最大时,所消耗的OH-的物质的量与100mlH2SO4提供的H+的物质的量相等。n(OH-)=1.00mol/L×0.650L=0.65mol,n(H2SO4)=1/2n(H+)=1/2×0.65mol,C(H2SO4)=0.325mol/0.1L=3.25mol/L
(3)Al2O3 0.05mol Fe2O3 0.05mol
26.向含有1molNH4Al(SO4)2的溶液中加入1mol/Lba(OH)2溶液至足量,画出整个过程的反应图象。
【答案】