高三化学第一学期第二阶段考试
高 三 化 学
考试时间 120分钟 满分 150分
本试卷分第I卷(选择题)和第II卷(非选择题)两部分
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Si:28 S:32 Cl:35.5 Na:23 Mg:24 Al :27 Ca:40 Fe:56 Cu:64 Zn:65
第I卷(选择题 共72分)
一、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个选项符合题意)
1.成功合成纳米氮化镓是我国科学家近年来取得的一项重大科技成果。已知镓是第ⅢA族元素,则氮化镓的化学式可能是
A.GaN B.G2N3 C.Ga3N2 D.G3N
2.下列各组物质发生状态变化时,所克服的微粒间的相互作用,属于同种类型的是
A.钠和硫的熔化 B.食盐和石蜡的熔化
C.碘和干冰的升华 D.二氧化硅和氧化钠的熔化
3.下列保存有关物质的方法,错误的是
A.常温下,浓硫酸用铝制容器盛放
B.烧碱溶液放在带橡胶塞的玻璃瓶中
C.浓硝酸放在带橡胶塞的棕色玻璃瓶中
D.少量白磷放在水中
4. 若以ω1和ω2分别表示浓度为amol·L-1和bmol·L-1氨水的质量分数,且知2a=b,氨水的密度比纯水小,则下列推断正确的是
A.2ω1=ω2 B.2ω2=ω1 C.ω1<ω2< 2ω1 D.ω2>2ω1
5.人体血红蛋白中含有Fe2+,如果误食亚硝酸盐会使人中毒,因为亚硝酸盐会使Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与O2的结合能力,服用维生素C可以缓解亚硝酸盐的中毒,这说明维生素C具有 A.酸性 B.碱性 C.氧化性 D.还原性
6.一定条件下,mg下列物质在足量O2中充分燃烧,产物用过量的Na2O2完全吸收后,Na2O2固体增重mg,符合此要求的组合是:①H2 ②CO ③H2和CO ④HCHO ⑤CH3OH ⑥HCOOCH3
A.除⑥外 B.①②③ C.④⑤⑥ D.全部
7. 将过量的SO2气体通入下列溶液中最终无沉淀的是
A.NaAlO2 B.BaCl2 C.Ba(NO3)2 D.Na2SiO3
8. 用石墨作电极,电解1mol / L下列物质的溶液,溶液的pH保持不变的是:
A.CuSO4 B.NaOH C.NaCl D.Na2SO4
9.关于胶体的叙述中不正确的是
A.利用电泳现象不一定能区别溶液和胶体
B.胶体都能发生丁达尔现象
C.胶体粒子的大小都在1nm-100nm之间
D.Fe (OH)3胶体在外加电场中向阳极移动
10. 某无色混合气体可能含有Cl2、O2、HCl、NH3、NO、NO2中的两种或多种,现将此混合气体经过浓硫酸后体积减小,将剩余气体排入空气中,很快变成红棕色。对于原混合气体成分的判断中,正确的是:
A.肯定有O2 B.肯定没有Cl2、NH3、NO2
C.肯定有NH3、NO、HCl D.肯定只有NH3和NO
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错1个,该小题就为0分)
11.由于人类向大气中排放有毒气体,形成南极臭氧层空洞,下列气体哪种是形成南极臭氧层空洞的罪魁 A.Cl2 B.HCl C.NO2 D.CCl2F2
12. 设NA为阿伏加德罗常数,则下列说法正确的是 A.124g白磷中含有P-P键的个数为6NA B.12g石墨中含有C-C键的个数为2NA C.12g金刚石中含有C-C键的个数为2NA D.60gSiO2中含有Si-O键的个数为2NA
|
14. 在一种PH=1的溶液中可能存在NO3-、I-、Cl-、Fe3+中的一种或几种,向该溶液中滴入溴水,单质溴被还原,由此推断该溶液 A.含NO3-、Fe3+,无I-,可能有Cl- B.含I-,不含NO3-、Fe3+,可能有Cl C.含I-、Fe3+、Cl-,肯定不含NO3- D.含I-、NO3-,肯定不含Fe3+
![]() 15. 对于可逆反应2SO2
+ O2
2SO3,下列判断正确的是:
15. 对于可逆反应2SO2
+ O2
2SO3,下列判断正确的是:
A.2体积SO2和足量O2混和反应,必定生成2体积SO3
B.其它条件不变,增大压强,平衡必定向右移动
C.平衡时,SO2消耗速率必定等于O2生成速率的2倍
D.平衡时,SO2浓度必定等于O2浓度的2倍
16. A、B为短周期元素,二者能形成化合物AB2。已知A的原子序数为n,B的原子序数为①n+2、②n+5、③n+10、④n+13、⑤n-3、⑥n-6、⑦n-8、⑧n+1,其中
A.①②⑤不可能 B.④⑥不可能
C.⑤⑥不可能 D.①~⑧都可能
17.在调整好的天平左右两盘中间各放一只大小和质量均相等的烧杯,两烧杯中都盛有2mol/L的稀硫酸50mL,然后分别向烧杯中加入下列各组物质,充分反应后天平仍保持平衡的是
A.左10g锌,右10g铁 B.左10g碳酸钠,右10g亚硫酸钠
C.左2g锌,右2g铁 D.左0.5g镁,右0.5g铝
18. 在一定体积的密闭容器中,进行如下可逆反应:CO2(g)+H2(g)=CO(g)+H2O(g),其化学平衡常数K和温度的关系如下表:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
根据以上信息作出的下列判断中正确的是
A.此反应为吸热反应
B.此反应只有在达到平衡时,密闭容器中的压强才不再变化
C.此反应在1000℃达平衡时,c(CO2)·c(H2)/[c(CO)·c(H2O)]约为0.59
D.1100℃时,此反应的K值可能为0.9
第II卷 (非选择题 78分)
三、(本题包括2小题,共20分)
19.(6分)在体积为250mL的锥形瓶内装有20mL H2O,同时收集满CO2气体,再加入一定量的金属钠后迅速塞紧瓶塞,充分反应后,其气球的变化有三种情况
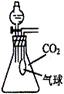 ①当气球无变化时,锥形瓶中反应后溶质为 _____________ ;
①当气球无变化时,锥形瓶中反应后溶质为 _____________ ;
②当气球膨胀时,锥形瓶中反应后溶质为 _____________ ;
③当气球瘪凹时,锥形瓶中反应后溶质为 _____________ 。
![]() 20.(14分)实验室中根据2SO2+O2
2SO3 △H=-196.6kJ,设计如图所示的实验装置来制备SO3固体
20.(14分)实验室中根据2SO2+O2
2SO3 △H=-196.6kJ,设计如图所示的实验装置来制备SO3固体
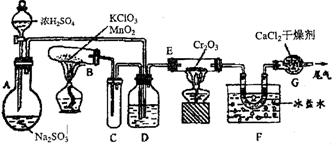
请回答下列问题:
(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)_______________(2)小试管C的作用是______________________________________________________
(3)广口瓶D内盛的试剂是_______________装置D的三个作用是:
①______________________________________________________________________;
②______________________________________________________________________;
③______________________________________________________________________.
(4)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防止温度过高,这样做的原因是______________________________________________________________
(5)装置F中U形管内收集到的物质的颜色、状态是___________________________
(6)装置G的作用是________________________________________________________
从G装置导出的尾气的处理方法是用试剂_________________________吸收。
四、(本题包括5小题,共44分)
21.(8分)某无色溶液A可能含有Cu2+ NH4+ Al3+ Mg2+ Fe3+ Na+ K+ CO32- SO42- 等离子中的一种或几种。取A加入Na2O2并加热,有无色无臭气体放出,同时生成白色沉淀,加入Na2O2的量X与生成白色沉淀的量W关系如右图。
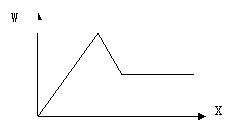 (1)A中一定含有的离子是____________________。
(1)A中一定含有的离子是____________________。
(2)A中一定不含的离子是_______________________。
(3)无法确定是否含有的离子是_______________________,
进一步确定的方法可以用___________________________________________
22.(12分) 右图表示的反应关系中,部分产物被略去,X为l mol固体,A、B、C各为l rnol无色气体,B在常温下为液体,D、E、F为气体,G为液体。则:
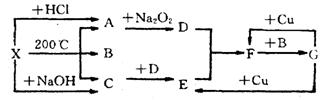
(1)写出化学式 X___________________,C_____________________。
(2) 写出化学方程式:
A→D_________ _______________________________ ____________________;
G→E______ ___________________________________ _______________________;
(3) 工业上合成C, 常用反应物______________________和_________________,合成后采用_____ ____________ __________________________方法分离出C,因为C_________________________________________________________________。
23.(8分)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应”式,另一个是“还原反应”式。如2Fe3++Cu==2Fe2++Cu2+的拆写结果是:氧化反应为:Cu-2e-==Cu2+;还原反应为:2Fe3++2e-==2Fe3+。
⑴请据此将反应3NO2+H2O==2H++2NO3-+NO拆写为两个半反应式。
其中还原反应___________________________________________。
氧化反应___________________________________________。
⑵已知某一反应的半反应式CH4+10OH- -8e-==CO32-+7H2O,O2+2H2O+4e-==4OH-。
则总方程式为____________________________________________________。
(3)熔溶盐燃料电池有很高的发电效率,它可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气和CO2混合气为阴极助燃气,制得在650℃下工作电池。已知阳极电池反应:2CO-4e- + 2CO32-== 4CO2 。
该电池阴极反应__________________________________________________
24.(8分)用“>、=、<”填写下列空白:
(1) 取0.2mol/LHX溶液与0.2mol/LNaOH溶液等体积混合,测得混合溶液中c(Na+)>c(X-)。
① 混合溶液中c(H+)______________C(OH-);
② 混合溶液中c(HX)+C(X-)_______________0.1mol/L
③ 混合溶液中水电离的c(OH-)_______________0.2mol/LHX溶液中水电离出的c(H+)
(2)如果取0.2mol/LHX溶液与0.1mol/LNaOH溶液等体积混合,测得混合溶液的pH>7,则说明HX的电离度____________NaX的水解度。
25.(8分)碳的稳定的氧化物除CO、CO2外,还有C3O2、C4O3、C5O2、C12O9等低价氧化物,其中C3O2是一种在常温下有恶臭的气体,其分子中的每个原子都满足最外层8电子结构。假设在一定条件下 CH3COOH→CH2=C=O+H2O。
①C3O2分子的电子式为________ ___;
②在上述碳的低价氧化物中,若有分子空间构型与 C3O2相同的,最可能是_____________;
③不考虑反应条件,根据你现有的化学知识判断, O2、HCl能与 C3O2发生反应,请将能够反应的化学方程式写在下面。
__________ __________________________________________________、
________________________________________________________________________。
五.计算题(2小题,共14分)
26.(4分)标准状况下,用一定量的水吸收氨气后制得浓度为12.0mol/L、密度为0.915g/mL的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。
(本题中氨的式量以17.0计,水的密度以1.00g/mL计)
27.(10分)现有等物质的量的NaHCO3和KHCO3的混合物a g 与100mL盐酸反应,题中涉及的气体体积均以标准状况计,填空时可以用带字母的分式表示
(1)该混合物中NaHCO3和KHCO3的质量比是___________________________
(2)如碳酸氢盐和盐酸恰好完全反应,则盐酸的物质的量浓度为________________________
(3)如盐酸过量,生成CO2体积为______________________________________________
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道__________________________________________________________________________。
(5)若NaHCO3和KHCO3不是以等物质的量的混合,则a g 混合物与足量的盐酸完全反应时生成CO2的体积范围是____________________
答案:
一、选择题 1.A 2.C 3.C 4 D 5 D 6 D 7 B 8 D 9D 10 D
二、选择题 11.CD 12AC 13 AB 14 B 15C 16D 17 A 18AC
三、19 (1) Na2CO3;(2)NaHCO3或Na2CO3和NaHCO3;(3)NaOH和Na2CO3
20(1)检查装置的气密性;(2)防止倒吸;(3)浓硫酸①吸收水蒸气;②控制SO2和O2的比例和速率;③混匀SO2和O2。(4) 该反应是放热反应,温度过高,SO3产率太低;(4)收集无色固体。(6)吸收空气中的水蒸气,用碱液吸收。
四、21(1)Mg2+ Al3+ SO42-;(2)Cu2+ Fe2+ CO32- NH4+;(3)Na+ K+,用Pt丝通过焰色反应来鉴别出它们,焰色为黄色,有Na+,透过钴玻璃焰色为紫色有K+否则无。
22(1) X是NH4HCO3或(NH4)2CO3 C NH3
(2)2Na2O2+2CO2=2Na2CO3+O2 3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O
(3) N2和H2,增压降温使氨液化而分离,氨分子间形成氢键而易液化。
23(1)NO2+2e-+2H+=NO+H2O 2NO2-2e-+2H2O=4H++2NO3-
(2)CH4+2O2+2OH-=CO32-+3H2O (3)2CO2+O2+4e-=2CO32-
24(1) ①< ② = ③ > (2) <
25 ① :O::C::C::C::O: ② C5O2
③ C3O2 +2O2==3CO2;O=C=C=C=O+2HCl→ClCOCH2COCl
五、26 V=378体积
27 (1)21:25;(2) c10a/92 (3)22.4a/92 (4) HCl的物质的量浓度
0.224a < V< 0.267a