高三化学第一学期期末考试试题3
可能用到的相对原子质量:Ar(H)=1 Ar(N)=14 Ar(O)=16 Ar(Mg)=24 Ar(Al)=27
Ar(S)=32 Ar(Fe)=56 Ar(Cu)=64 Ar(Zn)=65 Ar(Ag)=108
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.当前我国环保急待解决的“白色污染”,通常所指的是( )
A.烧制石灰时产生的白色粉尘 B.聚乙烯等塑料垃圾
C.金属冶炼厂排放的白色烟尘 D.白色建筑废料
2.工业上不生产次氯酸而生产漂白粉主要是因为( )
A.次氯酸是弱酸,漂白能力弱于漂白粉
B.漂白粉是液体,次氯酸是固体
C.次氯酸盐比次氯酸稳定
D.漂白粉成本低
3.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气在标准状况下的体积为11.2L
B.在常温常压下,11.2L氯气含有的分子数为0.5NA
C.25℃,1.01×105Pa,64Gso2中含有的分子数为0.5NA
D.标准状况下。11.2LNO和11.2LO2混合后,分子总数为NA
4.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确,且最后能得到较纯物质的是( )
| 选项 | 被提纯的物质 | 除杂试剂 | 分离办法 |
| A | 溴化钠溶液(碘化钠) | 氯水、四氯化碳 | 萃取、分液 |
| B | 碳酸钠晶体(碳酸氢钠) | —— | 灼烧 |
| C | 一氧化碳(二氧化碳) | 氧化铜粉末 | 通过灼热氧化铜粉末 |
| D | 氯化铵溶液(氯化铁) | 氢氧化钠溶液 | 过滤 |
5.在离子RO3n—中共x个核外电子,R原子的质量数为A,则R的原子核内含有中子的数目为( )
A.A+n+24-x B.A-n-24-x
C.A-n+24-x D.A+n+48-x
6.下列几组顺序排列不正确的是( )
A.微粒半径大小:S2—>Cl—>F—>Na+>Al3—
B.热稳定性大小:HF>H2O>NH3>PH3>SiH4
C.熔点高低:石墨>食盐>金属钠>冰
D.沸点高低:NH3>SbH3>AsH3>PH3
7.下列氧化还原反应中,氧化剂和还原剂的质量比为1 :2的是( )
![]() A.Fe+2FeCl3==3FeCl2
A.Fe+2FeCl3==3FeCl2
![]() B.3Cl2+6KOH 5KCl+KClO3+3H2O
B.3Cl2+6KOH 5KCl+KClO3+3H2O
![]() C.3S+6NaOH 2Na2S+Na2SO3+3H2O
C.3S+6NaOH 2Na2S+Na2SO3+3H2O
D.3C+SiO2 SiC+2CO
8.工业废气中的氮氧化合物是主要的大气污染源之一,为了保护环境,工业上常通入氨与之发生如下反应:NOx+NH3→N2+H2O,使之转化为无毒的N2.现有NO2和NO的混合气体3L,通入3LNH3(同温、同压下)恰好使其完全转化为N2。原混合气体中NO2和NO的物质的量之比为( )
A.1 :1 B.2 :1 C.3 :1 D.1 :4
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确的给2分,但只要选错一个,该小题就为0分。)
9.某学生做完实验后,采用下列方法清洗所用仪器。他的做法中正确的是( )
A.用热的纯碱溶液洗涤有油脂的试管
B.用酒精洗涤做过碘升华实验的烧杯
C.用稀盐酸清洗做银镜反应后的试管
D.用肥搭皂水洗涤盛放石灰水的试剂瓶
10.下列物质中,即可用人经合反应制取,又可用溶液中的复分解反应制取的是( )
A.NaOH B.Fe2S3 C.FeCl3 D.CuS
11.下列各对物质,化学键和晶体类型相同的是( )
①NaCl和NaOH ②Cl2和O2 ③Na2S和(NH4)S ④SiO2和CO2 ⑤晶体硅和水晶
A.①③⑤ B.②④ C.②⑤ D.②④⑤
12.在强酸性溶液中可以大量共存的离子组是( )
A.CO32—、SO42—、Na+、AlO2— B.SiO32、Na+、K+、Cl—
C.HCO3—、SO42—、Na+、S2— D.SO42—、Cl—、Na+、NH4+
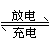 13.氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是
13.氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是![]() H2+NiO(OH)
Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
H2+NiO(OH)
Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,H2是负极
14.某种干燥粉末混合物可能由Na2O、Na2CO3、Na2O2、NaCl、NaHCO3中的两种或几种组成(假设固体混合时不反应)。若将春先与足量盐酸反应则逸出气体a,当a缓慢通过足量的NaOH溶液时气体体积缩小(同温、同压),但仍有剩余。另取原混合物在空气中加热至气体汪再发生,发现剩余固体的质量增加,则对原混合的叙述正确的是( )
A.一定含有Na2O和NaCl
B.一定含有Na2O、Na2O2、NaHCO3
C.不含有Na2CO3、Na2O2
D.不含有Na2CO、NaHCO3
15.装置如下图所示。药品A、D不溶于水,B、C是液体。甲、乙、丙、丁各装置分别起到制气、除杂、转化、有害尾气处理等作用。若丁处澄清石灰水变浑浊且逸出的气体可点燃,则下列各组中A、B、C、D药品正确的是( )
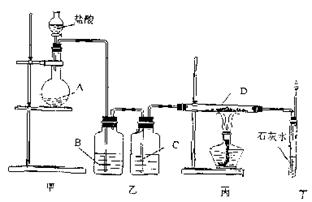 |
A.CaCO3、饱和NaHCO3溶液、浓H2SO4、C(木炭)
B.锌粒、NaOH溶液、浓H2SO4、Fe2O3
C.MnO2、NaOH溶液、浓H2SO4、Cu
D.Na2SO3、NaOH溶液、浓H2SO4、C(木炭)
16.A、B、C、D是四种短周期元素,A元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物E,1mol该化合物含有42mol电子;B原子的最外层电子数是次外层电子数的3倍;C元素是植物生长的营养元素之一,原子的最外层电子数是内层电子数的一半;D原子核内没有中子。则( )
A.离子化合物E的化学式为NH4NO3
B.B、D的元素符号分别为氧和氢
C.C元素是氮元素
D.由A、B、C、D四种元素共同组成的盐可超过4种
17.分别在pH=1的酸溶液和pH=14的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是( )
A.两种溶液体积相同,酸是强酸
B.两种溶液体积相同,酸是弱酸
C.酸溶液的体积比NaOH溶液体积大
D.酸是强酸,且酸溶液的浓度比NaOH溶液浓度大
18.CuI是一种白色不溶于水的固体,以石墨(阴)和铜(阳)为电极组成电解槽,以含有酚酞和淀粉的KI水溶液为电解液。电解开始后不久,阴极区溶液呈红色,而阳极区仍为无色。过了相当长的时间后,阳极区才呈浅蓝色,则电解开始时电极反应为( )
| 选项 | 阳极反应 | 阴极反应 |
| A | Cu—2e=Cu2+ | Cu2—+2e=Cu |
| B | 2Cu+2I—-2e=2CuI | 2H++2e=H2 |
| C | 2I—-2e=I2 | 2H++2e=H2 |
| D | Cu-2e=Cu2+ | 2H++2e=H2 |
三、(本题包括2小题,共20分。)
19.(8分)实验室有一瓶混有少量NaCl杂质的N aOH固体试剂。为准确测量其纯度,采用盐酸滴定法进行测定。
①称取WgNaOH固体配成100.00mL水溶液备用;
②将浓度为Cmol/L的标准盐酸装在用标准盐酸润洗过的25.00mL酸式滴定管中,调节液面位置在零刻度线以下,并记下读数为V1mL:
③取V2mLNaOH待测溶液置于洁净的锥形瓶中,加入2~3滴酚酞指示剂后摇匀,然用浓度为Cmol/L的标准盐酸滴定,终点时滴定管的读数为V3mL。
试回答:
(1)配制准确浓度的NaOH溶液,必须使用的主要容器是_______________。
(2)滴定终点时溶液颜色由___________色突变为__________色。
(3)实际用去标准盐酸的体积为___________mL。
(4)若有1mol/L和0.1mol/L两种标准盐酸可供选用,应该使用__________mol/L的盐酸,原因是______________________________________________________________。
(5)若滴定前滴定管尖嘴处有气泡,滴定中气泡被排出,会使碱液的测定值偏_______。
(6)用蒸馏水润洗而不用标准盐酸润洗滴定管,会使碱溶液的测定值偏__________。
20.(12分)设计4种不同类的验方法,证明盐酸的酸性强于碳酸。
| 编号 | 实验方法 | 实验现象 | 结论与解释 |
| 1 | |||
| 2 | |||
| 3 | |||
| 4 |
四、(本题包括2小题,共18分。)
21.(8分)含有18个电子的共价化合物中,除HCl、H2S、PH3、SiH4外,另外的符合此条件的4种化合物的化学式为___________、___________、___________、____________。
22.(10分)一个固定体积的密闭容器中,保持一定湿度,进行以下反应:H2(气)+Br2(气)
![]() 2HBr(气)。已知加入1molH2和2molBr2时,达到平衡后生成amolHBr(是下表“已知”项)。在相同条件下,且保持平衡时各组各的百分含量不变,对下列编号(1)~(3)的状态,填写表中的空白。
2HBr(气)。已知加入1molH2和2molBr2时,达到平衡后生成amolHBr(是下表“已知”项)。在相同条件下,且保持平衡时各组各的百分含量不变,对下列编号(1)~(3)的状态,填写表中的空白。
| 编号 | 起始状态(mol) | 平衡时HBr物质的量(mol) | ||
| H2 | Br2 | HBr | ||
| 已知 | 1 | 2 | 0 | A |
| (1) | 2 | 4 | 0 | |
| (2) | 1 | 0.5a | ||
| (3) | m | n(n≥2m) | ||
五、(本题包括2小题,共20分。)
23.(8分)有X、Y、Z三种单质,X是金属,常温下Y是液体,Z是气体,反应关系为:
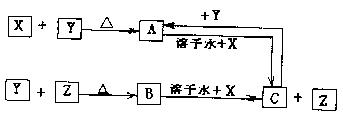 |
(1)据此推断X、Y、Z的化学式为:X_________,Y_________,Z__________。
(2)C+Y→A的离子方程式:___________________________________________
(3)X元素的核电荷数小于36,它是不是主族元素,简述理由。
___________________________________________________________________________
___________________________________________________________________________
24.(12分)已知可溶性硫化物在溶液中能与硫单质反应生成可溶性的多硫化物(如Na2Sn)。请回答下列问题:
(1)多硫化钠溶于水的电离方程式为___________________________________________。
(2)在浓Na2S溶液中滴入少量氯水,经振荡,未发现生成沉淀物,其原因是(只要求写出反应的离子方程式,下同)
___________________________________________________________________________
___________________________________________________________________________
(3)在足量氯水中,滴入少量Na2S溶液,经振荡,也未发现生成沉淀物,若再加入用盐酸酸化的BaCl2溶液,即可产生白色沉淀,其原因是
____________________________________________________________________________
____________________________________________________________________________
____________________________________________________________________________
六、(本题包括2小题,共20分。)
25.(8分)锌粉、铝粉、铁粉、镁粉的混合物a g与一定质量的溶质质量分数为25%的稀硫酸恰好完全反应,蒸发水分后得固体(不含结晶水)b g。求反应过程中生成氢气多少升(标准状况)?
26.(12分)现利用下图所示装置进行实验,接通电路一段时间后,丙电解槽阴极质量增重0.216g。求在这段时间内:
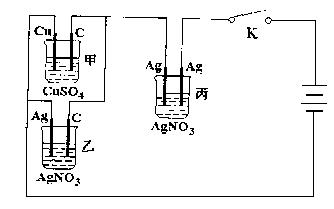 |
(1)甲、乙两电解槽产生的气体一共有多少升(标准状况)
(2)甲、乙两电解槽阴极总质量增重的范围。
常州市2002~2003学年第一学期期末考试高三化学试题评分标准和参考答案
一、单选题(本题包括8小题,每小题4分。共32分)
1.B 2.C 3.C 4.B 5.A 6.D 7.D 8.A
二、1~2 选题(本题包括10小题,每小题4分,共40分)
9.AB 10.AC 11.C 12.D 13.CD 14.B 15.A 16.AD 17.BC 18.B
三、(本题包括2小题,共20分)
19.(8分)(1)100mL的容量瓶(2)红 无 (3)V3—V1 (4)0.1 使用稀溶液滴定的误差小 (5)大 (6)大(每空1分)
20.(12分)(每空1分。合理答案均给分。)
| 实验方法 | 实验现象 | 结论与解释 | |
| 1 | 把稀盐酸滴入Na2CO3溶液中, 再把生成气人本通入石灰水中。 | 有气体生成,该气体能使澄 清石灰水变浑。 | 有CO2生成,说明盐酸酸性强于碳酸(强酸制取弱酸) |
| 2 | 用pH试纸溶液相同浓度的稀 盐酸和稀碳酸(CO2溶液)。 | 盐酸的pH小于碳酸的pH。 | 说明盐酸酸性强于碳酸(盐酸的[H+]大)。 |
| 3 | 在NaCl溶液和Na2CO3溶液里 分别滴入1滴酚酞试液。 | Na2CO3溶液能使酚酞变红, NaCl溶液不能。 | Na2CO3溶液呈碱性,NaCl溶液呈中性。则盐酸酸性强于碳酸。 |
| 4 | 在稀盐酸和稀碳酸中各放入一 颗锌粒。点燃生成的气体。 | 盐酸能与锌反应放出气体, 该气体能爆鸣:碳酸不能。 | 说明盐酸酸性强于碳酸(碳酸的酸性弱,不能与锌反应)。 |
四、(本大题包括2小题,共18分。)
21.(8分)H2O2、CH4O、C2H6、CH3F(或CH3NH2、N2H4、N2H4、NH2OH等)(每空2分)22.(10分)(1)2a(2)0 0.5 (3)2(n-2m) (n-m)a (每空2分)
五、(本题包括2小题,共20分。)
23.(8分)(1)X-Fe Y-Br2 Z-H2(各1分) (2)2Fe2++Br2=2Fe3++2Br(2分)
(2)不是(1分),因X是前四周期元素。且在A和C中显示不同正价。(2分)
24.(12分)(1)Na2Sn=2Na++Sn2— (2)S2—+(n-1)S=Sn2— (3)S2—+Cl2=S+2Cl—,S+Cl2+2H2O=SO42—+2Cl—+4H+,Ba2++SO42—=Ba SO4↓(各2分)
六、(本题包括2小题,共20分。)
25.(8分)设:生成H2的体积为x,SO42—的质量为(b-a)g(4分)。
SO42— ~ H2
96 22.4
(b-a)g x (2分) 解得x~0.23(b-a)L(2分)
26. (12分)解(1)Ag+e=Ag,丙槽中n(e )=0.216g/108g/mol=0.002mol (2分)
流经甲、乙两槽的电子的物质的量之和为0.002mol(2分)
4OH——4e—=2H2O+O2↑,V(O2)=0.002mol·22.4L/4mol=0.0112L(2分)
(2)流经甲、乙两槽的电子的物质的量不一定相等(1分)
若Ag几乎没有析出:m(Cu)=n(Cu)· M(Cu)=0.001mol·64g/mol=0.064g(2分)
若Cu几乎没有析出,则析出的Ag的质量与丙槽几乎相等,为0.216g。(2分)
则甲、乙两电解槽阴极总质量增重的范围在大于0.064g,小于0.216g之间。(1分)