高三化学第一学期期末考试试题
可能用到的相对原子质量:H 1 C 12 N 14 O 16 P 31 S 32 Cl 35.5 Na 23 K39 Fe 56
一、选择题(每小题只有一个选项符合题意)
1.我国“神舟五号”航天飞船成功发射升空,表明我国的载人航天技术已经有了突破性的进展。在运送飞船的某些火箭推进器中盛有液态肼(N2H4)和液态双氧水,它们充分混合反应后的产物之一是
A.氧气 B.氮气 C.氨气 D.氢气
2.通过化学反应不能实现的是
A.生成一种新离子 B.生成一种新分子
C.生成一种新核素 D.生成一种新单质
3.在水中溶入下列物质,可使水的电离平衡向右移动的是
A.H2SO4 B.NaOH C.NH4Cl D.Ba(NO3)2
4.希尔实验是将分离出的叶绿素加到草酸铁溶液中,经光照后发生反应:4Fe3++2H2O光照叶绿体4Fe2++4H++O2↑,下列有关该实验的说法错误的是
A.反应后溶液的pH降低
B.每生成1 mol O2转移4 mol电子
C.叶绿体被氧化
D.该实验可说明光合作用产生的氧气来源于水
5.用NA表示阿伏加德罗常数,下列说法正确的是
A.78 g Na2O2与足量水反应中电子转移了0.2NA
B.1 mol甲基中含有7 NA 个电子
C.62 g白磷中含P—P键为3 NA
D.1 mol氖气含有的原子数为2 NA
6.下列实验室制备有关物质的方法中,合理又实用的是
A.用含少量Cu2+的稀硫酸和锌粒反应制氢气
B.煅烧石灰石制备二氧化碳
C.用NH4Cl溶液和Ca(OH) 2溶液反应制氨气
D.用FeCl3溶液和NaOH溶液反应制Fe(OH) 3胶体
7.在含有I—且能使酚酞变红的无色溶液中,可大量存在的离子组是
A.Na+、Cu2+、Br—、Cl— B.AlO2—、K+、NH4+、Na+
C.K+、Na+、NO3—、H+ D.K++、S2—、SO42—、OH—
8.将1×10—3 mol•L—1的盐酸a L跟下列3种溶液混合后,溶液均成中性。
①1×10—3mol•L—1的氨水b L;②c(OH—)=1×10—3 mol•L—1的氨水c L;③c(OH—)=1×10—3 mol•L—1的Ba(OH)2 d L。其中a、b、c、d的关系正确的是
A.a=b>c>d B.b>a=d>c C.b>a>d>c D.c>a=d>b
二、选择题(每小题有1个或2个选项符合题意)
9.在下列条件下,两种气体的分子数一定相等的是
A.同质量不同密度的C2H4和CO
B.同温度同体积的C2H6和NO
C.同温度同压强的CO和N2
D.同体积、同压强的N2和C2H4
10.已知强酸与强碱在稀溶液里反应的中和热可表示为:
H+(aq)+OH—(aq)==H2O(l);△H= —57.3 kJ•mol—1
CH3COOH(aq)+NaOH(aq)==CH3COONa(aq)+H2O(l);△H=—Q1 kJ•mol—1
![]() H2SO4(浓)+NaOH(aq) ==
H2SO4(浓)+NaOH(aq) ==![]() Na2SO4(aq)+H2O(l);△H= —Q2 kJ•mol—1
Na2SO4(aq)+H2O(l);△H= —Q2 kJ•mol—1
HNO3 (aq)+NaOH(aq)==NaNO3 (aq)+H2O(l);△H= —Q3 kJ•mol—1
上述反应均系在溶液中进行的反应,Q1、Q2、Q3的关系正确的是
A.Q1=Q2=Q3 B.Q2>Q1>Q3 C.Q2=Q3>Q1 D.Q2>Q3>Q1
11.下列反应的离子方程式错误的是
A.NH4HCO3溶液与过量NaOH溶液反应:
NH4++OH—==NH3↑+H2O
B.向碳酸氢钙溶液中滴入少量的NaOH溶液:
HCO3—+Ca2++OH—==CaCO3↓+H2O
C.在Ba(OH) 2溶液中加入过量NH4HSO4溶液:
Ba2++2OH—+2H++SO42—==BaSO4↓+2H2O
D.草酸(乙二酸)和氨水反应:
HOOC—COOH+2NH3•H2O==C2O42—+2NH4++2H2O
12.某主族元素M的离子M2+具有6个电子层,最外层有2个电子,则M元素位于元素周期表的
A.第六周期 B.第七周期 C.ⅡA族 D.ⅣA族
13.一定温度和压强下,乙腈(CH3CN)是极易溶于水的无色液体,这时向质量分数为a的乙腈水溶液中加入等体积的水,所得溶液中乙腈的质量分数为0.4a。若同样条件下乙腈的密度为ρ1,水的密度为ρ2,则下列说法正确的是
A.ρ1<ρ2 B.ρ1>ρ2 C.ρ1=ρ2 D.无法确定
14.在一密闭容器中。反应mA(g)+nB(g)![]() pC(g)达平衡时,测得c(A)为0.5 mol•L—1 ;在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.3
mol•L—1,则下列判断正确的是
pC(g)达平衡时,测得c(A)为0.5 mol•L—1 ;在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.3
mol•L—1,则下列判断正确的是
A.化学计量数:m+n>p B.平衡向正反应方向移动了
C.物质B的转化率减小了 D.物质C的质量分数增加了
15.据报道,美国正在研究用锌电池取代目前广泛使用的铅蓄电池,它具有容量大的特点,其电池反应为2Zn+O2==2ZnO,其原料为锌粉、电解液和空气。则下列叙述正确的是
A.锌为正极,空气进入负极 B.负极反应为Zn—2e—==Zn2+
C.电解液肯定不是强酸 D.正极发生氧化反应
16.据报道,科学家最近确认世界上还存在着另一种结构与C60相似的“分子足球N60”。N60在高温或机械撞击后,其中积蓄的巨大能量会在一瞬间释放出来。对于N60,下列说法正确的是
A.N60是共价键构成的一种原子晶体
B.熔点:N60比N2高
C.稳定性:N60比N2高
D.等物质的量分解吸收的热量N60比N2高
17.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1︰16,则x值是
A.2 B.3 C.4 D.5
18.下列各组比较项目包含的数据关系中,前者比后者大的是
A.氯水与氨水中的粒子种数
B.同温下100 mL 0.1 mol•L—1 CH3COOH与10 mL 1 mol•L—1 CH3COOH溶液的pH
C.金属镁与金属铝的熔点
D.在物质的量浓度和体积都相等的NaAc和NaCl溶液中总离子数目
三、填空题
19.请用图中的装置设计一个实验以测定SO2转化为SO3的转化率:
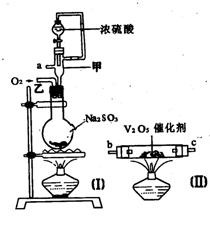
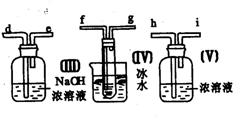
(1)这些装置的连接顺序(按气体从左到右的方向)是____→ ____→
__ →_____→____→____→___→____→(填各接口的编号)。
(2)实验时甲装置的作用是________________________________。
(3)从乙处均匀地通入O2,为使SO2有较高的转化率,实验时(Ⅰ)处滴入浓H2SO4与(Ⅱ)处加热催化剂的先后顺序是__________________。
(4)(Ⅳ)处观察到的现象是______________。
(5)在(Ⅰ)处用大火长时间加热烧瓶,SO2的转化率会_____(填“增大”、“减小”或“不变”),试说明原因_________________________。
(6)用n mol Na2SO3粉末与足量浓H2SO4进行此实验,当反应结束时,继续通入O2一段时间后,称得(Ⅲ)处增重m g(假设m g均为未反应的SO2,且SO2无其他损耗),则本实验中的转化率为__________。
20.现有由某种铁的氧化物与适量铝粉均匀混合而成的混合物,等分成两份后,一份与足量NaOH溶液反应放出H2 m g,一份隔绝空气加热,铝粉与铁的氧化物都恰好完全反应,将反应所得固体与足量盐酸反应,放出氢气n g。
(1)与NaOH溶液反应时,氧化剂是_________,与盐酸反应时还原剂是_________。
(2)若m︰n=1︰1,则铁的氧化物化学式为___________。
(3)若m︰n=4︰3,则该氧化物与铝粉反应的化学方程式为(标出电子转移方向和数目):_____________________________________________。
21.氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。工业上曾普遍采用高纯硅与纯氮在1300℃反应获得。
(1)氮化硅晶体属于__________晶体(填晶体类型)。
(2)已知氮化硅的晶体结构中,原子都以单键相连,且N原子和N原子、Si原子和Si原子不直接相连,同时每个原子都满足8电子稳定结构。请写出氮化硅的化学式___________。
(3)现用四氯化硅和氮气在氢气气氛保护下,加强热反应发生,可得较高纯度的氮化硅。反应的化学方程式为____________________________。
22.A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期,C是F不同周期的邻族元素。B原子最外层电子数比其次外层电子数多2;A、B两种元素的核电核数之差等于它们的原子最外层电子数之和;E和F 的原子序数之和为30。现有由上述六种元素中的两种元素组成的甲、乙、丙、丁、戊、己六种化合物,这些化合物中的原子个数比如下表:
| 化合物 | 各元素原子个数比 |
| 甲 | N(A)︰N (C)=2︰1 |
| 乙 | N(A)︰N (C)=1︰1 |
| 丙 | N(B)︰N (A)=1︰1 |
| 丁 | N(D)︰N (C)=1︰1 |
| 戊 | N(E)︰N (F)=1︰3 |
| 己 | N(B)︰N (F)=1︰4 |
请回答下列问题:
(1)化合物己的电子式为_________________。
(2)向乙的水溶液中加入MnO2,其氧化产物是________________。
(3)化合物丙中所有的原子都在同一直线上,实验室制取丙的化学方程式为_________________________________________。
(4)F的单质与甲反应的离子方程式为____________________________。
(5)戊与足量丁投入甲中发生反应的总化学方程式为:
____________________________________________________________。
23.已知某溶液中只存在OH—、H+、Na+、CH3COO—四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
① c(CH3COO—)>c(Na+)>c(H+)>c(OH—)
② c(CH3COO—)>c(Na+)>c(OH—)>c(H+)
③ c(Na+)>c(CH3COO—)>c(OH—)>c(H+)
④ c(Na+)>c(OH—)>c(CH3COO—)>c(H+)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是____________,上述四种离子浓度的大小顺序为_______(填序号)。
(2)若上述关系中①是正确的,则溶液中的溶质为____________;若上述关系中④是正确的,则溶液中的溶质为____________。
(3)若该溶液是由体积相等的稀醋酸和NaOH溶液混合而成,且恰好呈中性,则混合前c(CH3COOH)______c (NaOH)(填“大于”、“小于”或“等于”,下同),混合前酸溶液中c(H+)和碱溶液中c(OH—)的关系c(H+)______c(OH—)。
四、计算题
24.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。某厂废水中含KCN,其浓度为650 mg·L—1。现用氯氧化法处理,发生如下反应(其中N均为-3价):
KCN+2KOH+Cl2== KOCN+2KCl+H2O
投入过量液氯,可将氰酸盐进一步氧化为氮气:
KOCN+KOH+Cl2 → CO2 + N2 + KCl +H2O
若处理上述废水1000 L,使KCN完全转化为无毒物质,至少需液氯多少克?需1 mol•L—1 KOH 溶液多少升?
25.将2 mol A和2 mol B置于1 L容器中,在一定条件下,加热至高温,发生如下可逆反应:2A (g)![]() 2C+D 2 B+D2
2C+D 2 B+D2![]() 2E
2E
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是______和______,或______和______。
(2)若平衡时D和E的物质的量分别为n(D)平=a mol,n(E)平=b mol。
试求n(A)平=_______(用含a、b的代数式表示)。
高三化学答卷
班级 学号 姓名 成绩
一、选择题(每小题只有一个选项符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|
|
|
|
|
|
|
|
|
二、选择题(每小题有1个或2个选项符合题意)
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|
|
|
|
|
|
|
|
|
|
|
三、填空题
19.(1) (2)
(3) (4) 。
(5) (6)
________________________________________________________.
20.(1) (2)
③ ;
21.(1) (2)
③ ;
22.(1) (2)
(3)
(4)
(5)
23.(1) 、
(2) 、
(3) 、 。
四、计算题
24.
25.(1) 、
、
(2)
【参考答案】
一、选择题
1.B 2.C 3.C 4.C 5.C 6.A 7.D 8.B
二、选择题
9.A 10.D 11.A 12.AD 13.A 14.AC 15.BC 16.BD 17.D 18.AB
三、填空题
19. (1) a h i b c f g d (2) 使浓H2SO4顺利滴入烧瓶
(3)先加热催化剂后滴浓H2SO4 (4)无色针状晶体
(5)减小 ;混合气温度高,不反应放热,来不及氧化,平衡向逆反应方向移动
(6)1-![]()
20.(1)H2O;Fe (2) FeO
![]() 24e
24e
(3)3Fe3O4+8Al 4Al2O3+9Fe
21. (1)原子 (2)Si3N4
(3)3SiCl![]() +2N2+6H2 Si3N4+12HCl
+2N2+6H2 Si3N4+12HCl
22.(1)略 (2)O2
(3)CaC2+2H2O = Ca(OH)2+C2H2↑
(4)Cl2+H2O = HClO+H++Cl-
(5)AlCl3+2Na2O2 = NaAlO2+3NaCl+O2↑
23.(1)CH3COONa 、③
(2)CH3COONa+CH3COOH、CH3COONa+NaOH
(3)大于、小于
四、计算题
24. 1775g Cl2 ; 40L KOH
25.(1)B、E A、C (2)(2-2a-b)mol