高三毕业班化学第二次模拟考试
化学试卷
第I卷(选择题,共72分)
可能用到的相对原子质量:H 1 C 12 O 16 Fe 56 Na 23 Mg 24 S 32 Ba 137

1.以NA表示阿佛加德罗常数,下列说法中正确的是
A. 含106g碳酸钠的溶液中含NA个CO32-
B.0.1molOH-含NA个电子
C.1.8g重水(D2O)中含NA个中子
D.11.2L臭氧中含有1.5NA个氧原子
2.A、B、C为短周期的三种元素,A、B处于同周期,A、C的最低价离子分别为A2-、
C-,A2-的离子半径大于C-,B2+与C-具有相同的电子层结构。以下叙述不正确的是
A.原子半径:A>B>C B.原子序数:A>B>C
C.离子半径:A2->C->B2+ D.最外层电子数:C>A>B
3. 下列实验操作,对实验结果无影响的是
A.配制一定物质的量浓度的NaOH溶液时,烧碱在称量过程中发生潮解
B.配制一定物质的量浓度的H2SO4溶液时,空容量瓶内壁附着蒸馏水
C.在利用中和滴定测定未知浓度的碱液时,加入甲基橙或酚酞1~2ml
D.用pH试纸测定其溶液的pH值时,用玻棒把待测液滴在湿润的pH试纸上,然后用标准比色卡对比而得到pH值
4. 下列说法正确的是
A.在晶体中只要有阳离子就一定有阴离子
B.原子晶体的熔点一定比金属晶体的高
C. 两种微粒的质子数和电子数均相等,它们可能是一种分子和一种离子
D.不同的原子化学性质可能相同
5. 在PH=1的NaNO3溶液中能够大量共存的是
A. K+、Na+、SO32-、Cl- B. Na+、Ba2+、AlO2-、Cl-
C. NH4+、K+、Cl-、SO42- D. K+、Fe2+、Cl-、SO42-
6.下列离子方程式书写正确的是
A.向漂白粉溶液中通入少量的 SO2: Ca2++2ClO-+SO2+H2O= CaSO3↓+2HClO
B.碳酸氢钙溶液跟过量氢氧化钠溶液反应:Ca2++HCO3-+OH- CaCO3↓+H2O
C.少量浓亚硫酸氢铵溶液加入浓氢氧化钠溶液中:
NH4++HSO3-+2OH-=SO32-+NH3↑+2H2O
D.氯化铝溶液与过量的氨水反应:Al3++4NH3·H2O AlO2-+4NH4++2H2O
7. 在PH值相同的四种一元酸A、B、C、D的溶液各20mL,与过量Mg充分反应后,产生氢气的质量是D>C>A=B。下列说法正确的是:①D的酸性最强 ②A与B的酸性最强且彼此相当 ③反应后原D溶液的PH最大 ④反应后原A和B溶液的PH最大 ⑤反应前D溶液的物质的量浓度最大 ⑥反应前四种溶液的物质的量浓度一样大
A.②③⑤ B.①④⑥ C.②④⑤ D.①③⑤
8. 向倒扣在水槽中盛有NO的试管中缓慢通入35 mL O2,反应完成后,若试管内液面仍保持在原来的位置,则试管中原来的NO体积为
A.20 mL B.15 mL C.10 mL D.5 mL

9. 有两种短周期元素X和Y,可组成化合物XY3 ,若X原子序数为a,Y原子序数为b,则a + b不可能的是
A. a + b=16 B. a + b=30
C. a + b=24 D. a + b=43
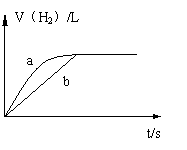 10. 一定质量的钠、钾分别投入一定量的盐酸中,在相同条件下产生氢气的体积随时间变化的曲线如图中a、b所示。则下列说法正确的是:
10. 一定质量的钠、钾分别投入一定量的盐酸中,在相同条件下产生氢气的体积随时间变化的曲线如图中a、b所示。则下列说法正确的是:
A.投入的钠、钾物质的量一定相等。
B.曲线a对应的反应使用了催化剂
C.曲线a代表钾的反应,曲线b代表钠的反应
D.两次反应中盐酸必须是足量的
11. 三硫化四磷的分子结构研究表明,该分子中没有不饱和键,且各原子的最外层都达到了8个电子的结构。在一个三硫化四磷分子中含有的共价键个数是
A.7个 B.9个 C.19个 D.不能确定
12. 以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到4mol Fe(OH)3沉淀,此间共消耗的水的物质的量为
A.8mol B.10mol C.11mol D.12mol
13.下列各溶液中,微粒的物质的量浓度关系正确的是
A. 0.1mol.L-1的(NH4)2SO4溶液中,c(SO42- )>c(NH4+ )>c(H+)>c(OH-)
B. 0.2m01.L-1的Na2CO3溶液中,c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
C. 0.1mol .L-1的NH4Cl溶液与0.05mol L-l的NaOH溶液等体积混合
c(Cl- ) >c(Na+ ) >c(NH4+ ) >c(OH- ) >c(H+)
D. c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液以及NH4C1溶液,
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4C1)
14.下列说法正确的是
A. NH4H固态时属离子晶体,溶于水时电离出氢离子和铵离子,溶液显酸性
B.冰、水中都含有氢键,分子间形成的氢键使物质的熔点、沸点升高
C. 含有阳离子的晶体一定是离子晶体
D.含有非极性键的化合物一定是共价化合物
15. 下面是实验室制取氨气的装置和选用的试剂,其中错误的是
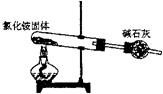
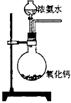


A. B. C. D
16. 生物体中细胞膜内的葡萄糖、细胞膜外的富氧液体及细胞膜构成微型的生物原电池。据此判断下列说法正确的是
A.正极的电极反应可能为:O2+4e-+2H2O=4OH-
B.负极的电极反应可能为:O2+4e-=2O2-
C.负极主要反应是C6H12O615.生成C2H5OH
D.正极反应主要为C6H12O615.生成CO2或HCO3-
17. 为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=![]() ,则下列叙述正确的是
,则下列叙述正确的是
A.中性溶液的AG=0 B.酸性溶液的AG<0
C.常温下0.1mol/LNaOH溶液的AG=12 D.常温下0.1mol/L盐酸溶液的AG=12
18. 在一定温度下的定容容器中,当下列物理量不再发生变化时,表明反应A(s)+2B(g)![]() C(g)+D(g)已达平衡状态的是
C(g)+D(g)已达平衡状态的是
A.混合气体的压强 B.混合气体密度
C.混合气体的总质量 D.气体总物质的量
高三毕业班第二次模拟考试
化 学 试 卷
| 题号 | 一、二 | 三 | 四 | 五 | 六 | 总分 |
| 得分 |
|
|
|
|
|
|
第I卷 答 题 卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|

 第II卷(非选择题,共78分)
第II卷(非选择题,共78分)
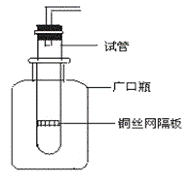
19. (6分)某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的类似于启普发生器的简易气体发生器的装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体 ,若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体 (用化学式表示)。
写出反应的离子方程式
20. (16分)工业产品碳酸钠中,常混有氯化钠,测定碳酸钠质量分数的仪器装置图下: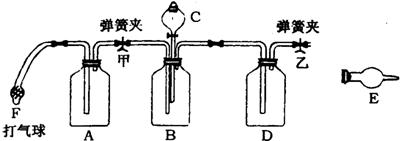
供选用的试剂有:NaOH溶液、饱和石灰水、蒸馏水、浓硫酸、稀硫酸、浓盐酸、稀盐酸、硝酸、碱石灰、无水氯化钙、无水硫酸铜、试样(含有少量氯化钠的碳酸钠)。
请回答:(1)各有关仪器中使用的药品及作用:
A ,作用 ;
C ,作用 ;
D ,作用 ;
E ,作用 ;
F的作用:第一次 ;第二次 ;
(2)实验步骤(到得到实验数据止):
①称量:称试样质量及装有干燥剂的球形干燥管的质量,并记录数据。
②
③向有关仪器中装上药品待用
④
⑤关闭甲弹簧夹,将分液漏斗中的液体加到装有试样的广口瓶中
⑥
 ⑦称量干燥管质量并记录数据。
⑦称量干燥管质量并记录数据。
21.(10分)过氧化氢(H2O2)俗称双氧水,近年来倍受人们的青睐,被称为“绿色氧剂”。
(1) 你认为H2O2被称为“绿色氧化剂”的主要原因是:
(2)已知金属属离子Fe2+、Mn2+、Cu+ 和Cr3+ 等在酸性条件下可催化双氧水分解。试写出双氧水(H2O2)被Fe2+催化分解的机理,用离子方程式表示:
(3)经测定,H202为二元弱酸,其酸性比碳酸弱,写出H202在水溶液中的电离方程式:
(4)将Cu放入稀硫酸中不发生反应,但再加入H2O2 则Cu被溶解写出离子反应方程式 。
22.(8分)已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的式量比D的式量大16,在一定条件下,各物质相互转化关系如下图所示:
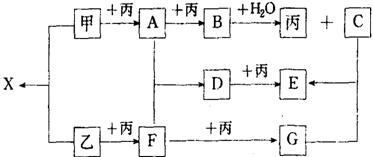
(1) 写出X的电子式和G的化学式X ,G
(2) 写出有关变化的化学方程式
B+H2O: ;
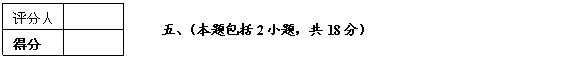 D+丙:
D+丙:
23.(4分)短周期的两种非金属元X、Y,能按原子个数比1 :3组成化合物,且每个原子最外层都已达到了稀有气体原子所具有的稳定结构,写出满足要求的四种常见化合物的化学式:
24.(14分)已知H3PO4为三元酸,结构式为:
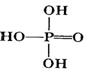
次磷酸的分子式为H3PO2是一种弱酸,它与过量的NaOH溶液反应后的产物为NaH2PO2
① 次磷酸是一种 元弱酸,次磷酸的钠盐水溶液呈 性,原因是:
(用离子方程式表示)。
② 由题意可推知次磷酸的结构式可为 ;
③ 将0.1mol NaH2PO2与0.05mol HCl溶于水配成0.5L混合液,若溶液呈碱性,则此溶液中共有 种微粒,溶液中各种微粒浓度(mol·L-1)由大到小的顺序是 。
(2)抽烟对人体有害,烟草不完全燃烧产生的一氧化碳被吸进肺里跟血液中的血红蛋白(用Hb表示)化合,发生下述反应:![]() 实验表明:Hb·CO的浓度 即使只有Hb·O2浓度的2%,也足以使人的智力受损,请回答:
实验表明:Hb·CO的浓度 即使只有Hb·O2浓度的2%,也足以使人的智力受损,请回答:
①上述反应的平衡常数表达式为:K=___________;
 ②抽烟后,吸入肺部的空气中测得的CO和O2的浓度分别为10-6mol·L-1和10-2mol·L-1,已知37℃时,平衡常数K=220,这时Hb·CO的浓度___________(填“大于”、“等于”或“小于”) Hb·O2的浓度
②抽烟后,吸入肺部的空气中测得的CO和O2的浓度分别为10-6mol·L-1和10-2mol·L-1,已知37℃时,平衡常数K=220,这时Hb·CO的浓度___________(填“大于”、“等于”或“小于”) Hb·O2的浓度
25.(8分)为了将10.0mL同时含H2SO4和HNO3的溶液完全中和,共消耗16.8mL浓度为2.38mol·L-1的Ba(OH)2溶液,这时生成了7.0g沉淀。
(1)若将上述混合酸加水稀释到800.0mL,求稀释后溶液的pH。
![]()
![]()
(2)若用惰性电极来电解50.0mL上述混合酸,一段时间后在两极共收集18.67L(标准状况)混合气体,求电解后溶液中氢离子的物质的量浓度。(设电解前后混合酸的密度均为1g·cm-3)
26.(12分)在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g) ![]() 3C(g)
已知加入1mol A和3mol B且达到平衡时生成amol C。
3C(g)
已知加入1mol A和3mol B且达到平衡时生成amol C。
(1)达到平衡时C在反应混合气体中的物质的量百分含量为 (用含a关系式表示)
(2)在相同实验条件下,若在同一容器中改为加入2mol A和6mol B,达到平衡后,C的物质的量为 (用含a关系式表示)。此时C在混合气体中的物质的量百分含量 (填增大、减少或不变)。
(3)在相同实验条件下,若在同一容器中改为加入2mol A和8mol B,若要求平衡后C在反应混合气体中的物质的量百分含量不变,还应加入 C mol。
(4)若在同一容器中,加入n mol A和3n mol B,则平衡时C的物质的量为m mol。若改变实验条件,可以使C的物质的量在m~2m间变化,那么n、m的取值范围是
(用含字母n、m的关系式表示)。
(5))若上述可逆反应一开始就从逆向建立平衡,达到平衡后,再将C物质的量加倍,则C的分解率 (填“增大”、“减小”或“不变”)
三毕业班第二次模拟考试参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | A | B | D | C | C | A | A | D |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | AC | B | B | BD | B | AC | A | AD | BC |
19. H2, CO2 , H2S(H2S没写不扣分) (2分)
H2(若后面方程式写成金属与酸反应,该空格不得分)(2分)
2Al+2OH-+2H2O=2AlO2-+3H2↑
(或Si+2OH-+H2O=SiO32-+2H2↑) (2分)
20. (1)
A.饱和石灰水或 NaOH溶液(1分);吸收空气中的CO2(1分);
C.稀H2SO4(1分)(若答盐酸、HNO3,0分);使试样转化成 CO2(1分);
D.浓H2SO4(1分);干燥CO2气体(1分)
E.碱石灰(过量)(1分);吸收反应产生的CO2 (1分)
F.第一次鼓空气,以赶尽仪器装置中有CO2的空气 (1分)
第二次鼓空气,赶出残留在仪器装置中反应产生的CO2 (1分)
(2)
②在接球形干燥管前,先检查装置的气密性;(2分)
④打开甲、乙弹簧夹,用气球鼓气,以赶尽装置中的CO2,然后接上已称量过装有吸收剂的球形干燥管; (2分)
⑥反应完全后,打开弹簧夹甲用气球鼓气,直至装置中的CO2全部赶出为止;
(2分)
21.(1)因双氧水参加反应后的产物是水,无污染 (2分)
(2)2Fe2+ +H2O2 + 2H+ =2Fe3++2H2O (2分)
2Fe3+ + H2O2 = 2H+ +2Fe2+ +O2↑ (2分)
(3)H2O2 ![]() H+ +HO2-
HO2-
H+ +HO2-
HO2- ![]() H+ + O22-(2分)
H+ + O22-(2分)
(4)Cu + H2O2 +2H+ =Cu2+ + 2H2O (2分)
22.(1)Na+[![]() ]2-Na+(2分) SO3 (2分)
]2-Na+(2分) SO3 (2分)
(2)2Na2O2+2H2O=4NaOH+O2↑(2分)2Na2SO3+O2=2Na2SO4(2分)
23.NH3 、PH3 、PCl3 、C2H6 (每个化学式1分,共4分)
![]()
![]()
 24.(1)① 一
(1分),碱性(1分)H2PO2-+H2O
24.(1)① 一
(1分),碱性(1分)H2PO2-+H2O![]() H3PO2+OH-(2分)
H3PO2+OH-(2分)
② (2分)
③ 7种 (2分)c(H2O)>c(Na+)>c(H3PO2)>c(Cl-)>c(H2PO2-) >c(OH-)>c(H+)(2分)
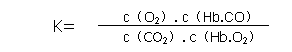 (2)
①
(2分)
(2)
①
(2分)
② 小于 (2分)
25.(1)Ba(OH)2物质的量:![]() (1分)
(1分)
10mL溶液中含n(H+)= 0.04mol×2=0.08mol (1分)
c(H+)=8mol.L-1
∴稀释后H+的浓度:
c(H+)=0.08mol/0.8L=0.1mol.L-1 (1分)
|
![]() (2)∵ 电解混酸实际上就是电解水 (1分) 2H2O=2H2
↑+ O2↑
(2)∵ 电解混酸实际上就是电解水 (1分) 2H2O=2H2
↑+ O2↑
36g 67.2L
m 18.67L
m=36g×18.67L/67.2L=10g (1分)
∴ 电解后混酸的体积: V=50mL-10mL=40mL (1分)
c(H+)= 8mol.L-1×0.05L/0.04L=10 mol.L-1 (1分)
26. (1) 25a%; (2分)
(2)2a,不变; (2分)
(3)6; (2分)
(4)n>2m/3 (2分)
(5)不变 (2分)