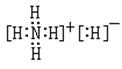高三第四次月考化学试卷
1.诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中的丝和蜡分别是
A 纤维素和烃 B 蛋白质和烃 C 纤维素和脂肪 D 蛋白质和脂肪
2.在盛有10mL水的烧杯中滴入1滴(约为0.05mL)1mol/L的盐酸,溶液的pH值约为
A 2-3之间 B 3-4之间 C 6-7之间 D 5-6之间
3.美国“9·11”恐怖袭击事件给纽约带来了一场严重的环境灾难——石棉污染,易使吸入石棉纤维者患肺癌。已知石棉是硅酸盐矿物,某种石棉的化学式可表示为Ca2MgxSiyO22(OH)2,x、y的值分别为
A.8,3 B.5,8 C.3,8 D.5,5
4.2002年9月14日南京汤山发生了一起震惊全国的特大投毒案,犯罪分子在食品中投入了毒鼠剂——毒鼠强,导致200多人中毒,42人抢救无效死亡;已知毒鼠强的结构简式如下图,有关毒鼠强(化学名:四亚甲基二砜四氨)的下列相关说法正确的是
A.毒鼠强属于无机物 B.毒鼠强属于烃
C.四个氮原子构成正四面体 D.毒鼠强的分子式为C4H8N4S204
5.从20世纪20年代起,就有人预言可能存在由4个氧原子构成的氧分子,但一直没有得到证实。最近,意大利一所大学的科学家使用普通的氧分子和带正电的氧离子制造出了这种新型氧分子,并用质谱仪探测到了它存在的证据,若该氧分子具有空间对称结构,你认为该氧分子是
A、氧元素的一种同位素 B、臭氧的同分异构体
C、一种新的氧化物 D、可能是非极性键构成的非极性分子
6.下列实验中用错试剂的是
A 用稀盐酸清洗做焰色反应的镍铬丝 B用酒精萃取碘水中的碘
C 用稀硝酸洗去残留在试管壁上的铜 D用碱石灰吸收氨气中的水蒸气
7.某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。在恒温恒压条件下,将此气体通过浓H2SO4时,总体积基本不变,通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4变色。则原混合气体的成分是
A CO和HCl B H2、CO和HCl C CH4和NH3 D CO、CO2和HCl
8.在常温下10mL pH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7,则对反应溶液的叙述正确的是( )
A.C(A-)<C(K+) B. C(A-)>C(K+)
C.V(HA)≥10mL D.V(HA)≤10mL
9.在一定温度下,有m1gKCl饱和溶液,其溶质的质量分数为c1%.采取某种措施后析出m2gKCl晶体,母液质量为m3g,其溶质的质量分数为c2%. 则下列关系正确的是 ( )
A.c1一定大于c2 B.原条件下KCl的溶解度小于c1g
C.m1-m2≤m3 D.m1c1-m3c2=100m2
10.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法中,不正确的是 ( )
A.1molNH5中含有5NA个N—H键(NA表示阿伏加德罗常数)
|
C.NH5的电子式为:
D.它与水反应的离子方程式为:NH4++H-+H2O=NH3·H2O+H2↑
11.把6 mol气体A和5 mol气体B混合后充入4 L密闭容器中在一定条件下反应:3A (g) + B (g) ![]() x C (g) + 2 D (g),在5 min时达到平衡,此时生成2 mol D,并测得C的平均速率为0.1 mol /(L•min),则下列结论错误的是
x C (g) + 2 D (g),在5 min时达到平衡,此时生成2 mol D,并测得C的平均速率为0.1 mol /(L•min),则下列结论错误的是
A. x的值为1 B. B的平衡浓度为1.0 mol /L
C. B的转化率为20% D. A的平均速度为0.15 mol / (L•min)
12.“过氧化氢”(H2O2)被称为“绿色漂白剂”,下列叙述中不正确的是
A.H2O2分子中含有O2-离子
B.纯H2O2是液体,能与水以任意比例混合
C.H2O2常用作医用消毒剂
D.在酸性溶液中H2O2是强氧化剂,而还原性较弱
13.下列离子方程式书写正确的是
A 标准状况下2.24L ![]() 通入100
通入100![]()
![]() NaOH溶液中:
NaOH溶液中:![]()
B 向漂白粉溶液中通入![]() 气体:
气体:![]()
C
![]() 水解:
水解:![]()
![]()
![]()
D 等物质的量的![]() 与
与![]() 在溶液中反应:
在溶液中反应:
![]()
14.将两个铂电极插入500mL的CuSO4溶液中进行电解,当电解液的pH从6.0变为3.0时(电解液在电解前后体积变化忽略不计),电极上析出铜的质量是
A 8mg B 16mg C 32mg D 64mg
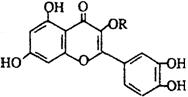 15.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是
15.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是
A 可以和溴水反应 B 可用有机溶剂萃取
C 分子中有三个苯环
D 1mol维生素P可以和4molNaOH反应
高三第四次月考答题卡
原子量:Cu:64;S:32;O:16;H:1;
| 题号 | 一 | 二 | 三 | 四 | 五 | 总分 |
| 得分 |
一、选择题(共45分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 |
二、填充题(共14分)
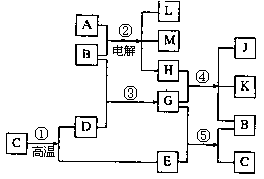 16.(6分)根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,E是一种无刺激性气味的气体,反应⑤是实验室鉴定化合物E的反应,H是一种有刺激性气味的气体。
16.(6分)根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,E是一种无刺激性气味的气体,反应⑤是实验室鉴定化合物E的反应,H是一种有刺激性气味的气体。
(1)单质L是 。
(2)化合物B是 。
(3)图中除反应①以外,还有两个用于工业生产的反应,是 和 (填代号)。它们的化学反应方程式分别是:
和 。
17.(8分)有A、B、C、D四种元素,它们的原子序数由A至D逐渐增大,D的氢化物分子式为H2D,D在最高价氧化物中质量分数为40%,而且D的原子核内质子数和中子数相等;A和B原子有相同的电子层数。A原子的最外层电子数是次外层电子数的2倍;B的阴离子、C的阳离子和Ne原子的电子层结构相同。通常状况下B的单质是气体,0.1 molB的单质和H2充分反应时,有2.408×1023个电子转移;C的单质在高温下与B的单质充分反应可得淡黄色固体,此生成物与AB2反应可生成B的单质,由以上叙述回答:
(1)C、B单质反应生成的淡黄色固体的电子式为_____________。AB2结构式为 ,分子的空间构型为 , AB2的晶体属于 晶体。
(2)淡黄色固体与AB2反应可生成B的单质的化学方程式为
(3)C和D组成的化合物溶于水,溶液并不显中性的原因是(用离子方程式稀释):
。
三、实验推断题(18分)
18.(8分)下面a~e 是中学化学实验中常见的几种定量仪器:
a、量筒 b、容量瓶 c、酸式滴定管 d、碱式滴定管 e、托盘天平 f、温度计
(1)其中标出仪器使用温度的是___________(填写编号)。
(2)能够用以精确量取液体体积的是____________(填写编号)。
(3)上述仪器中,用6mol/L的NaOH溶液配制250mL 0.5mol/L的NaOH溶液时,必须用到的仪器有 (填写编号)。
(4)由于错误操作,使得到数据比正确数据偏小的是 (从下列A、B、C中选)。
A、用量筒最取一定量液体时,俯视液面读数
B、中和滴定达终点时俯视滴定管的液面读数
C、使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度
19.(10分)某学生欲用H2O2催化分解来制取氧气,用浓氨水和生石灰反应来制取氨气。现有下列仪器装置(另有短乳胶管)可供选择:
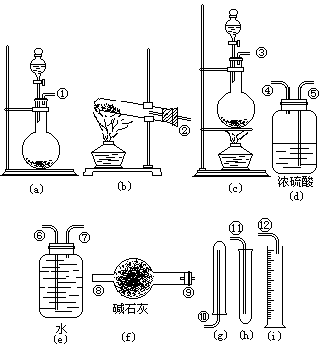
(1)若制取干燥氧气,应选用的仪器是_________________________,按气流方向连接的顺序是________________________________;
(2)若测定生成O2体积以确定H2O2含量应选用的仪器是____________________,按气流方向连接的顺序是________________________________。
(3)标准状况时,若量取a mL H2O2溶液(密度为1g/cm3)完全反应后,收集到b L O2,则H2O2溶液中溶质的质量分数为
四、有机推断题(14分)
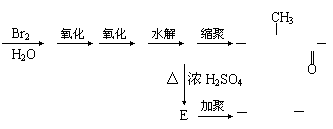
20.(6分)中国是《日内瓦协定书》的缔约国,一贯反对使用化学武器,反对任何形式的化学武器扩散。苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式为:
![]()
试回答下列问题:
(1)苯氯乙酮的分子式为 。
(2)苯氯乙酮不可能具有的化学性质是:_____________(填序号)。
A.加成反应 B.取代反应 C.消去反应 D.水解反应 E.银镜反应
| |
| |
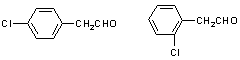
![]()
![]() 21.(8分)为了减轻“白色污染”对环境造成的污染,铁道部曾下令全国铁路餐车停止使用聚苯乙烯制造的餐具,改用可降解塑料 [ O—CH—C ]n,该塑料在乳酸菌作用下迅速
21.(8分)为了减轻“白色污染”对环境造成的污染,铁道部曾下令全国铁路餐车停止使用聚苯乙烯制造的餐具,改用可降解塑料 [ O—CH—C ]n,该塑料在乳酸菌作用下迅速
分解为无毒物质,下面是这种可降解塑料的一种合成途径。
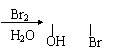 已知烯烃在水存在下与氯、溴加成,能产生在相邻不饱和碳上连有卤素和羟基的化合物。例如:
已知烯烃在水存在下与氯、溴加成,能产生在相邻不饱和碳上连有卤素和羟基的化合物。例如:
CH2 CH2 CH2—CH2
 可降解塑料的合成流程为:
可降解塑料的合成流程为:
CH3—CH CH2 A B C D [ O—CH—C ]n
[ C3H4O2 ]n
(1)(4分)写出C、D结构简式
C: D:
(2)(4分)完成下列化学方程式
A→B:
![]() E→ [ C3H4O2
]n :
E→ [ C3H4O2
]n :
五、计算(9分)
22.(9分)Ⅰ、恒温、恒压下,在一个可变容积的容器中发生如下反应:
A(g)+B(g)![]() C(g)
C(g)
(1)若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为
mol
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol
(3)若开始时放入xmolA、2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3amol,则x= ,y= 。平衡时B的物质的量为 (选填一个编号)
(甲)大于2mol (乙)等于2mol
(丙)小于2mol (丁)可能大于、等于或小于2mol
作出此判断的理由是 。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
Ⅱ、若维持温度不变,在一个与(1)反应前起给体积相同、且容积固定的容器中发生上述反应
(5)开始时放入1molA和1molB,到达平衡后生成bmolC,将b与(1)小题中的a进行比较 (选填一个编号)
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出断判断此的理由是 。
高三第四次月考答案
一、选择题(共45分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | B | A | B | D | D | B | A | D | D | A | A | A | A | B | C |
二、填充题(共14分)
16.(6分)(1) H2 。(2) H2O 。(3) ② 和 ④
![]()
![]()
![]() 2NaCl+2H2O==2NaOH+H2↑+Cl2↑ 和 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
2NaCl+2H2O==2NaOH+H2↑+Cl2↑ 和 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
17.(8分)(1) O=C=O 直线型 分子晶体。
(2)2Na2O2+2CO2==2Na2CO3+O2
(3)S2-+H2O==HS-+OH- HS-+H2O==H2S+OH-
三、实验推断题(18分)
18.(8分)(1)a b c d (2)c d (3)a b d (4)B
19.(1)a d h或a f h ①接⑤接④接⑾或①接⑥接⑦接⑾ (2)a e I (3)17b/5.6a
四、有机推断题(14分)
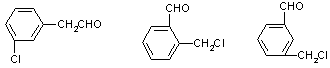
20.(6分)(1) C8H7OCl (2) C E (3)
![]() CHO
CHO
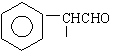
![]()
CH2Cl
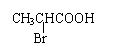
![]() 21.(8分) CH3CHCOOH
21.(8分) CH3CHCOOH
OH
(2)(4分)完成下列化学方程式(略)
五、计算(9分)
22.(9分)(1) 1-a mol (2) 3a mol(3)x= 2 ,y= 3-3a 。 (丁)
作出此判断的理由是(略)
(4) a/(2-a) 。(5)(乙) 作出断判断此的理由是(略)