高三寒假检测化学试卷
本试卷分为第Ⅰ卷和第Ⅱ卷,考试时间为90分钟,满分为100分
本试卷可能用到的相对原子质量:H—1,D—2,C—12,N—14,O—16,Na—23
第Ⅰ卷(选择题,共40分)
一、选择题(每小题只有1个正确选项,共16分)
1.在科学史上,中国有许多重大发明和发现,为世界现代物质文明奠定了基础。以下发明和发现属于化学史上中国对世界重大贡献的是
①造纸 ②印刷技术 ③火药 ④指南针 ⑤炼铜、炼铁 ⑥合成有机高分子材料 ⑦人工合成蛋白质
A.①②③④ B.①③⑤⑦ C.②④⑥ D.⑤⑥⑦
2.2003年2月,广东部分地区发生了非典型肺炎,其原因是由病毒感染所引起的。不少群众购买醋精用于室内消毒灭菌,这是因为醋精
A.沸点低 B.有酸味 C.能使蛋白质变性 D.具有医疗保健作用
3.在无色透明的酸性溶液中,能共存的离子组是
A.Na+、Mg2+、NO3-、SO42- B.CO32-、NO3-、Al3+、Cl-
C.MnO4-、K+、SO42-、Na+ D.K+、SO42-、Fe2+、NO3-
4.在烧杯中加入水和苯(密度:0.88g/cm3)各50mL。将一小粒金属钠(密度:0.97g/cm3)投入烧杯中。观察到的现象可能是
A.钠在水层中反应并四处游动 B.钠停留在苯层中不发生反应
C.钠在苯的液面上反应并四处游动 D.钠在苯与水的界面处反应并可能作上、下跳动
5.氟气是氧化性最强的非金属单质。在加热条件下,等物质的量氟气与烧碱完全反应,生成NaF、H2O和另一种气体,该气体可能是
A.H2 B.HF C.O2 D.OF2
6.下列说法中正确的是(NA表示阿伏加德罗常数)
A.80g硝酸铵含有氮原子数为2NA
B.在标准状况下,11.2L氖气中含有NA个氖原子
C.2 mol/L Na2SO4溶液中含有4NA个Na+
D.NA个水分子的质量之和等于水的摩尔质量
7.正电子、反质子等都属于反粒子,它们跟普通电子、质子的质量、电量均相等,而电性相反。科学家设想在宇宙的某些区域可能存在完全由反粒子构成的物质——反物质。1998年初和年底,欧洲和美国的科研机构先后宣布:他们分别制造出9个和7个反氢原子,这是人类探索反物质的一大进步。你推测反氢原子是:
A.由1个带正电的质子和1个带负电的电子构成
B.由1个带负电的质子和1个带正电的电子构成
C.由1个不带电的中子和1个带负电荷的电子构成
D.由1个带负电荷的质子和1个带负电荷的电子构成
![]() 8.Fe(NO3)2溶液呈浅绿色,其中存在下列平衡:Fe2++2H2O Fe(OH)2+2H+,往该溶液逐滴加入盐酸,发生的变化是 (已知3Fe2++4H++NO3-=3Fe3++NO↑+2H2O)
8.Fe(NO3)2溶液呈浅绿色,其中存在下列平衡:Fe2++2H2O Fe(OH)2+2H+,往该溶液逐滴加入盐酸,发生的变化是 (已知3Fe2++4H++NO3-=3Fe3++NO↑+2H2O)
A.平衡不移动 B.平衡向正方向移动
C.溶液颜色由浅绿色变为棕黄色 D.溶液颜色由浅绿色变为深绿色
二、选择题(每小题只有1个正确选项,共24分)
![]() 9.黑龙江省齐齐哈尔市2003年8月4日发生一起侵华日军遗弃化学毒剂芥子气泄漏致多人受伤事件。芥子气学名为“二氯二乙硫醚”,被称为“毒气之王”,结构见下图,它为无色油状液体,工业品呈棕褐色,有大蒜气味,沸点219℃,液体密度1.27g/cm-3;难溶于水,易溶于有机溶剂(汽油、煤油、酒精),能溶于动植脂肪中;常温水解极慢,加热能使水解加快;能与高锰酸钾、漂白粉及硫化钠溶液反应。战争使用状态为液滴态或雾状。下列有关芥子气的叙述正确的是
9.黑龙江省齐齐哈尔市2003年8月4日发生一起侵华日军遗弃化学毒剂芥子气泄漏致多人受伤事件。芥子气学名为“二氯二乙硫醚”,被称为“毒气之王”,结构见下图,它为无色油状液体,工业品呈棕褐色,有大蒜气味,沸点219℃,液体密度1.27g/cm-3;难溶于水,易溶于有机溶剂(汽油、煤油、酒精),能溶于动植脂肪中;常温水解极慢,加热能使水解加快;能与高锰酸钾、漂白粉及硫化钠溶液反应。战争使用状态为液滴态或雾状。下列有关芥子气的叙述正确的是
A.它能水解生成二羟二乙硫醚 B.化学性质不稳定,易分解
C. 中毒后使细胞组织坏死、糜烂,但能较快愈合 D.常温下它易挥发
10.第3周期元素R,它的原子核外最外层上达到饱和所需电子数小于次外层和最内层电子数之差,且等于最内层电子数的正整数倍。则关于R的正确说法是
A.R能形成稳定的气态氢化物
B.R的最高价氧化物对应水化物是强酸
C.R和R的氧化物的熔点和硬度都很高
D.常温下,能稳定存在的R的高价氧化物都能与烧碱溶液反应
11.下列可用相同的方法除去混有的杂质的是
A.Fe(OH)3胶体中混有少量NaCl及盐酸,淀粉溶液中混有少量KI
B.淀粉溶液中混有少量NaCl,蔗糖中混有少量NaCl
 C.Na2CO3中混有少量NaHCO3、NaHCO3中混有少量Na2CO3
C.Na2CO3中混有少量NaHCO3、NaHCO3中混有少量Na2CO3
D.铁粉中混有少量硫粉,碘中混有NaCl
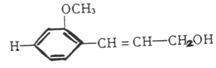
12. 从松树中分离出松柏醇,其结构简式为:
下列叙述正确的是
A.它难溶于水,也不溶于有机溶剂
B.1mol该化合物最多能与4molH2发生加成反应
C.它不溶于NaHCO3溶液,但可与NaOH溶液发生中和反应
D.1mol该化合物在溴水中最多能与4molBr2发生加成反应
13.下列反应的离子方程式书写正确的是
A.氯化铁溶液中通入SO2气体 Fe3+ +SO2 +2H2O = Fe2+ +SO42— + 4H+
B.Na2CO3溶液中滴加盐酸至刚好出现气泡时停止 CO32—+2H+ = CO2↑+H2O
C.向烧碱溶液中通入少量SO2气体 SO2+OH-=HSO3-
D.向Ba(OH)2溶液中逐滴加入NH4HSO4至刚好沉淀完全
Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+H2O
14.电解含有重水(D2O)的普通水时,在两极共收集到气体18.5 g,其体积恰好是33.6L(标准状况)。这些气体中普通氢和重氢(D)的原子个数比为
A.1︰1 B.2︰1 C.3︰1 D .4︰1
15.五氧化二氮是白色固体,熔点为30℃,升温时易液化和气化,并发生以下两个相互联系的反应:①N2O5(g)![]() N2O3(g)+O2(g);②N2O3(g)
N2O3(g)+O2(g);②N2O3(g)![]() N2O(g)+O2(g)。在0.5L密闭溶器中,将2.5mol N2O5加热气化,并按上述①②两式分解,在某温度下达到平衡,测得O2的平衡浓度为4.4mol·L-1,N2O3的平衡浓度为1.6mol·L-1,则下列各项判断正确的是:
N2O(g)+O2(g)。在0.5L密闭溶器中,将2.5mol N2O5加热气化,并按上述①②两式分解,在某温度下达到平衡,测得O2的平衡浓度为4.4mol·L-1,N2O3的平衡浓度为1.6mol·L-1,则下列各项判断正确的是:
A.N2O5的平衡浓度为3.0mol·L-1 B.N2O5的转化率为60%
C.平衡时N2O3的物质的量为0.7mol D.N2O的平衡浓度为4.4mol·L-1
16.在含有Cu(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中,加入铁粉,经反应后未见气体放出,当析出3.2gCu时,溶解的铁粉的质量是
A.2.8g B.5.6g C.8.4g D.14g
第Ⅱ卷(非选择题,共60分)
三、本大题包括3小题(共20分)
17.(6分)X、Y、Z是短周期元素的三种常见氧化物。X跟水反应后可生成一种有还原性的不稳定二元酸,该酸化学式是 ▲ ;Y和X的组成元素相同,Y的化学式是 ▲ ;1mol Z加热时跟水反应的产物需要用6mol的氢氧化钠才能完全中和,Z的化学式是 ▲ ,其中和产物的化学式是 ▲ 。在一定条件下,Y可以跟非金属单质A反应生成X和Z,其反应的化学方程式是 ▲ 。
18.(9分)固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,该物质适当加热就分解成两种气体,试回答:
(1)固体A属于 ▲ 晶体,它的电子式为 ▲ ;
(2)A溶于水后溶液呈 ▲ 性(填“酸”、“碱”或“中”),其原因是(用化学方程式表示) ▲ ;
(3)A与铜或铜的某些化合物在一定条件下可合成CuH,CuH是一种难溶物,它能在氯气中着火,还能与盐酸反应放出气体,请写出这两种反应的化学方程式
▲ , ▲ 。
19.(5分)在10.0℃和2×105Pa的条件下,aA(g)![]() dD(g)+eE(g) 建立平衡后,再逐步增加体系的压强(温度维持不变),下表列出了不同压强下反应建立平衡时物质D的浓度:
dD(g)+eE(g) 建立平衡后,再逐步增加体系的压强(温度维持不变),下表列出了不同压强下反应建立平衡时物质D的浓度:
| 压强(Pa) | 2×105 | 5×105 | 1×106 |
| D的浓度(摩/升) | 0.085 | 0.20 | 0.44 |
据表中数据,可见压强从2×105 Pa增至5×105 Pa,平衡向 ▲ 方向移动,作出这种判断的理由是 ▲ ;当压强由5×105 Pa增加到1×106 Pa时,平衡向 ▲ 方向移动, 作出这种判断的理由是
▲ ,平衡之所以向该方向移动,这是由于 ▲ 。
四、本大题包括2小题(共17分)
20.(5分)下面a~e是中学化学实验中常见的几种定量仪器:
a. 量筒、b. 容量瓶、c. 滴定管、d. 托盘天平、e. 温度计。
(1) 其中标有“0”刻度,且“0”刻度在上方的仪器是 ▲ (填编号);
(2) 能够用以精确量取液体体积的是 ▲ (填写编号);
(3) 由于错误操作, 使得到的数据比正确数据偏小的是 ▲ (填写编号):
A. 用量筒量取液体时, 俯视液面读量取体积;
B.中和滴定达终点时,俯视液面读数,计算消耗溶液体积;
C.用容量瓶配制一定物质的量浓度溶液, 定容时俯视液面所配得溶液浓度;
(4) 有下列实验:①苯与溴的取代反应,②苯的硝化反应,③乙醛的银镜反应,④石油分馏实验,⑤乙酸乙酯的制取。其中需要使用温度计的有 ▲ (填写编号)。
21.(12分)实验室里临时需要用NaOH溶液和CO2来制取纯Na2CO3溶液。已知CO2气体在通入NaOH溶液过程中极易过量生成NaHCO3,且无明显现象。
实验室有下列试剂:①未知浓度的NaOH溶液;②37%的盐酸;③37%的硫酸;
④14%的盐酸;⑤大理石;⑥K2CO3固体;⑦Cu2(OH)2CO3。
实验室有下列仪器:铁架台、启普发生器、量筒、烧杯、橡皮管、玻璃导管、分液漏斗。
已知下表中各物质在常温时的溶解度(g/100g H2O)
| Na2CO3 | NaHCO3 | NaCl | Na2SO4 | NaHSO4 | NaOH |
| 15.9 | 8.4 | 35.0 | 35.5 | 20.0 | 40.0 |
(1)本实验应选用的仪器:除烧杯、量筒、橡皮管、玻璃导管外,还需要 ▲ ;
(2)为保证制得的Na2CO3溶液尽量纯,应选用的药品(写编号):除①外,还需要
▲ ;
(3)简要叙述实验步骤,直到制得纯Na2CO3溶液(仪器安装可省略):
▲ ;
(4)根据给出的溶解度表,求出当NaOH溶液中溶质的质量分数大于多少时,在配制过程中有晶体析出(写出计算步骤和必要的文字说明) ▲ 。
五、本大题包括2小题(共10分)
22.(3分)与甲酸的相对分子质量相差14,但不是甲酸同系物的有机物的结构简式为
▲ 、 ▲ 、 ▲ 。
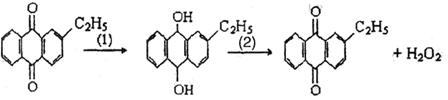
23.(7分)工业上可用乙基醌经两步反应制备H2O2,其工艺流程可简单表示如下:
|
(1)涉及还原反应的方程式可写成 ▲ ,
涉及氧化反应的方程式可写成 ▲ 。
(2)“绿色化学”是当今社会人们提出一个新概念,“绿色化学”工艺中原子利用率为100%,不产生副产物。试问该法生产H2O2可否成为理想状态的“绿色化学”工艺? ▲ (填“是”或“不是”),并简述理由 ▲ 。
六、本大题包括2小题(共13分)
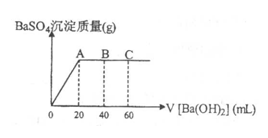 24.(5分)t℃时,稀硫酸和盐酸混合溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向20mL该混合酸溶液中逐滴加入pH=11的Ba(OH)2溶液,生成BaSO4的量如图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),试计算:
24.(5分)t℃时,稀硫酸和盐酸混合溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向20mL该混合酸溶液中逐滴加入pH=11的Ba(OH)2溶液,生成BaSO4的量如图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),试计算:
(1)最初混合酸溶液中:
c(H2SO4)= ▲ ,c(HCl)=___ ▲____;
(2)A点的pH=_____▲____;
(3)B点比最初混合酸的pH增加多少(写出计算过程)?(lg3=0.48)
25.(8分)往400mL 0.3mol/L NaOH溶液中通入一定量的CO2气体,然后在低温下蒸发溶液,得白色固体A为7.6g。试推算:
(1)A的可能成分;
(2)组成A的物质的质量;
(3)求通入的CO2气体在标准状态下的体积。