高考化学综合试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间为90分钟。
可能用到的相对原子质量:
H:1 C:12 N:14 O:16 Na:23 Fe:56
第I卷(选择题,共50分)
一、选择题(本题包括10个小题,每小题3分,共30分。每小题只有一个选项符合题意。)
2.下列各组物质中,其化学键类型不完全相同,但晶体类型相同的是 ( )
A.H2O , KCl B.SiO2, CO2 C.Br2, H2 D.NaCl, NaOH
4.下列关于胶体的叙述不正确的是 ( )
A.布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区别开
B.光线透过胶体时,胶体发生丁达尔效应
C.用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
D.能电后溶液中溶质离子向两极移动,胶体中分散质粒子向某一极移动
6.下列各物质中,按熔点由高到低的顺序排列正确的是 ( )
A.CH4>SiH4>GeH4>SnH4 B.KCl>NaCl>MgCl2>MgO
C.Rb>K>Na>Li D.石墨>金刚石>二氧化硅>硅
|
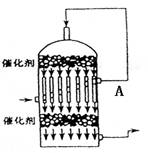
A.SO2转化为SO3时采用常压,是因为
增大压强不会提高SO2的转化率
B.如图是硫酸工业流程中的一个设备,
该设备就是热交换器
C.从图中A口逸出气体的主要成分是:
SO2、SO3 、O2
D. 用黄铁矿制得的炉气会使催化剂中毒,
所以必须对其进行净化
8.若某池(电解池或原电池)的总反应离子方程式是 :Cu+2H+=== Cu2+ +H2↑,关于此池
的有关说法正确的是 ( )
A.该池可能是原电池,也可能是电解池
B.该池只能是原电池,且电解质溶液为硝酸
C.该池只能是电解池,且金属铜为该电解池的阳极
D.该池只能是电解池,电解质溶液可以是硝酸
9.一定条件下硝酸铵受热分解的反应式为:NH4NO3→HNO3+N2+H2O 在反应中,被氧化与
被还原的氮原子个数之比为 ( )
A.5:3 B.5:4 C.1:1 D.3:5
12.下列各组离子,因氧化还原反应而不能大量共存的是 ( )
A.K+、Na+、 Cl-、NO3- B.H+、Na+、 NO3-、I-
C.K+、Ba2+、 SO42-、NO3- D.H+、Na+、 CO32-、Cl-
13.下列反应的离子方程式正确的是 ( )
A.将氢碘酸加到Fe(OH)3胶体中:Fe (OH)3 +3H+=Fe3++3H2O
B.碳酸氢钙溶液中中入少量烧碱:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O
C.新制氯水中滴入少量溴化亚铁溶液:
2Fe2++4Br-+3Cl2=2Fe3++2Br2+6 Cl-
D.锌与1mol·L-1HNO3溶液反应:Zn+2H+=2 Zn2++H2↑
14.在水中加入等物质的量的Ag+、Pb2+、Na+、SO42-、NO3-、Cl-,用惰性电极电解此溶液,
通电片刻,则氧化产物与还原产物的质量比为 ( )
A.35.5:10.8 B.16:207 C.8:1 D.108:35.5
15.下列实验操作方法正确的是 ( )
A.在试管中加入2mL10%的CuSO4溶液,然后加入4至6滴10%的NaOH溶液振荡、
再加入几滴乙醛溶液加热煮沸,可以检验乙醛分子中的醛基
B.测定CuSO4晶体结晶水含量时,当灼烧晶体至全部变为白色粉末后,露置在空气中
冷却至室温称取其质量
C.用氢氧化钠溶液清洗盛过苯酚的试管
D.向溴乙烷中滴加硝酸酸化的AgNO3溶液,以检验其中的溴元素
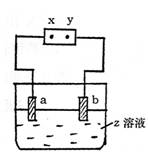
16.如图所示,x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色
|
|
第Ⅱ卷(非选择题 共49分)
三、(本题包括2小题,共14分)
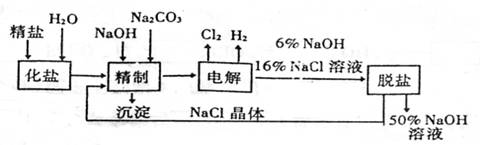
19.(8分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意示图如下:
|
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生的电极反应式为 ,
与电源负极相连的电极附近,溶液的pH (填“升高”、“降低”或“不变”)。
(2)为有效除去粗盐中含有的Ca2+、Mg2+和SO42+,供选用的试剂有BaCl2、Ba(NO3)2、KOH、NaOH、K2CO3、Na2CO3,应选用的试剂及其加入的正确顺序是 。
(3)在用离子交换膜法电解食盐水时,阳离子交换膜将电解槽分隔为阳极室和阴极室的目的是 、
。采用无隔膜电解冷食盐水时,Cl2与NaOH充分接触,产物只有NaClO和H2,则电解反应的化学方程式为 。
四、(本题包括3小题,共22分)
21.(6分)配平下列离子方程式,并回答问题:
 (1)
Fe(OH)3+ ClO- + OH-——
FeO4n-+
Cl-+
(1)
Fe(OH)3+ ClO- + OH-——
FeO4n-+
Cl-+
H2O
(2)若有3.21gFe(OH)3参加反应,共转移了5.42×102个电子,则n= ,FeO4n-中铁的化合价为 。
(3)试推测FeO4n-能与下列哪些物质反应(填序号) 。
A.Cl2 B.SO2 C.H2S D.O2
22.(7分)某无色溶液可能是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe(SO4)3、
(NH4)2 SO4溶液中的两种或两种以上混合而成。取该溶液,向其中加入稀硫酸,有白色沉淀生成;继续加入稀硫酸,沉淀又完全消失,整个实验过程中无气体产生。
(1)原溶液是由 和 溶液混合而成的。
(2)整个实验过程中,有关反应的离子方程式是 、 、
。
五、(本题包括2小题,共13分)
23.(4分)已知下列两个热化学方程式;
H2(g)+![]() O2(g)==== H2O(l ); △H= -285.8kJ/ mol
O2(g)==== H2O(l ); △H= -285.8kJ/ mol
C3H8(g)+5O2(g) ==== 3CO2(g) +4H2O(l) ; △H= -22220.0 kJ/ mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热5297.4kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(l)=H2O(g);△H=+44.0 kJ/ mol
试写出丙烷燃烧生成CO2和水蒸气热化学方程式。
化学试题参考答案及评分标准
第I卷(选择题,共50分)
一、选择题(3分×10=30分)
1.C 2.D 3.C 4.A 5.B 6.D 7.D 8.C 9.A 10.D
二、选择题(3分×7分=21分)
11.D 12.B 13.C 14.C 15.C 16.A 17.B
(说明:选择题每小题皆为3分)
第Ⅱ卷(非选择题 共49分)
三、(共14分)
18.(6分)
(1)溶液变浑浊,C6H5ONa+CO2+H2O→ C6H5OH+NaHCO3 (每空1分,共2分)
(2)浓氨水,硝酸银,CH3CHO+2Ag(NH3)2OH CH3COONH4+2Ag↓+3NH3+H2O,防止试管中液体发生倒吸(每空1分,共4分)
19.(8分)(1)2Cl--2e-=Cl2↑,升高(每空1分,共2分)
(2)NaOH、Ba Cl2、Na2CO3或BaCl2、NaOH、Na2CO3(2分)
(3)防止阴极产生的H2、和阳极产生的Cl2混合而引起爆炸,避免Cl2和NaOH溶液反应生成NaClO而影响烧碱的质量。(2分)
NaCl+H2O 电解 NaClO+H2(2分)分步写出亦可)
四、(共22分)
20.(9分)
![]() CH3
CH3
CH3
CH3
![]()
![]()
![]() (1)A:CH2===
C—CH3
G:[ CH2—C ] n (每空2分,共4分)
(1)A:CH2===
C—CH3
G:[ CH2—C ] n (每空2分,共4分)
COOH
(2)②(1分)
![]()
![]() CH3
CH3
CH3
CH3
 |
(3)2 CH3—C—CH2OH+O2 2CH3—C—CHO +2H2O(2分)
OH OH
(4)酯化反应,2mol(每空1分,共2分)
21.(6分)
(1)2,5-n, 2n, 2, 5-n , n+3 (2分) (2)2,+6(每空1分,共2分)(3)B、C(2分)
22.(7分)
(1)NaOH, AlCl3 (每空2分,共4分)
(2)Al3+ +4OH- ==== AlO2- +2H2O AlO2-+H+ +H2O==== Al(OH)3↓
Al(OH)3+3H+ ==== Al3+ +3H2O(每空1分,共3分)
五、(共13分)
![]() 23.(4分)(1)3:2 (2)C3H8(g)+5O2(g) 3CO2(g)
+4H2O(g); △H=-2044kJ/mol(每小题2分)
23.(4分)(1)3:2 (2)C3H8(g)+5O2(g) 3CO2(g)
+4H2O(g); △H=-2044kJ/mol(每小题2分)
24.(9分)
解:由题目给定条件可知:气体通体足量Na2O2后,体积减少1.792L,应是CO2与Na2O2反应所致(因标准状况下水是液态)。
2CO2+2Na2O2==== 2Na2CO3+O2
故燃烧后生成CO2的体积是2×1.792L,则剩余O2体积为
4.00L+0.224L-1.792×2=0.64L
据质量守恒定律m(羧酸)+m(O2)→m(CO2)+m(H2O)
其中m(O2)=![]()
m(O2)=![]()
m(H2O)=m(羧酸)+m(O2)-m(CO2)
=3.32g+4.80g-7.04g=1.08g(3分)
3.32g芳香中含C、H、O元素的物质的量
n(C)=![]()
n(H)=![]()
m(O)=3.32g-0.160mol×12.0g·mol-1-0.120mol×1.00g·mol-1=1.28g
n(O)=![]()
故羧酸中C、H、O的原子个数和比为4:3:2;(3分)
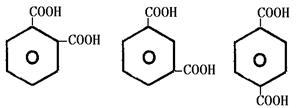
由于芳香族羧酸分子中碳原子数一定大于6,故相对分子质量最小的芳香族羧酸分子式为C8H6O4,(1分)其可能的结构简式有
|
(2分,不全者酌情扣分)