高考理科综合测试化学部分(二)
8.设NA为阿伏加德罗常数,下列说法正确的是
A.6.2 g白磷分子中含P-P键数为0.05NA
B.1 mol CH+3含电子数为8 NA
C.标准状况下22.4 L SO3中含原子数为4 NA
D.常温常压下11.2 L CO2气体通过足量Na2O2充分反应,转移电子数为2 NA
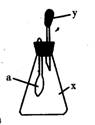 9.如图所示,锥形瓶中盛有气体x,滴管内盛有液体y。若挤压滴管胶头,使液体y滴入瓶中,振荡,过一会可见小气球a鼓气。气体x和液体y不可能是
9.如图所示,锥形瓶中盛有气体x,滴管内盛有液体y。若挤压滴管胶头,使液体y滴入瓶中,振荡,过一会可见小气球a鼓气。气体x和液体y不可能是
A.x又是NH3,y是水 B.x是SO2,y是NaOH浓溶液
C.x是CO2,y是稀H2SO4 D.是HCl,y是NaNO3稀溶液
10.一定条件下,AL密闭容器中放入1mol N2和3mol H2,发生N2+3H2![]() 2NH3的反应,下列选项中能说明反应已达到平衡状态的是
2NH3的反应,下列选项中能说明反应已达到平衡状态的是
A.c(N2):c(H2):c(NH3)=1:3:2
B.v(N2)=3v(H2)
 C.单位时间内1个N≡N键断裂的同时,有6个N-H键断裂
C.单位时间内1个N≡N键断裂的同时,有6个N-H键断裂
D.单位时间消耗0.1molN2的同时,生成0.2molNH3
11. 分析右面的能量变化示意图,确定下列选项中正确的是
A.2 A(g)+ B(g)=2 C(g); △H<0
B.2 A(g)+ B(g)=2 C(g); △H>0
C.2 A + B=2 C;△H<0
D.2 C=2 A +B ;△H<0
12.在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2 ![]() N2O4;△H<0。若把烧瓶置于100℃的沸水中,下列情况:①颜色②气体的相对平均分子质量③质量④压强⑤密度中不变的是
N2O4;△H<0。若把烧瓶置于100℃的沸水中,下列情况:①颜色②气体的相对平均分子质量③质量④压强⑤密度中不变的是
A.③④ B.③⑤
C.②④ D.①③
13.某温度下,w g某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加w g。在①H2②CO ③CO和H2的混合气 ④HCHO ⑤CH3COOH
⑥HO—CH2—CH2—OH中,符合题意的是
A.均不符合 B.只有①②③ C.只有④⑤ D.全部符合
14.在有乙离子存在的情况下,欲用试剂丙来检验溶液中是否含有甲离子,下表所加试剂丙能够对甲离子进行成功检验的是:(说明:在实验过程中不允许加热、过滤、萃取等操作)
| 选项 | 试剂丙 | 甲离子 | 乙离子 |
| A | 稀盐酸、Ba(NO3)2溶液 | SO42- | SO32- |
| B | AgNO3溶液 | Cl- | I- |
| C | KSCN溶液 | Fe2+ | Fe3+ |
| D | 稀氨水 | Al3+ | Ag+ |
15.用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg [c(H+)/ c(OH一)] 。常温下,在AG=10的溶液中能大量共存的离子是
A.Ca2+、K+、Cl-、SO32- B.NH4+、Fe2+、 I一、SO42-
C.Na+ 、K+、ClO-、S2- D.Na+、S2O32-、AlO2—、K+
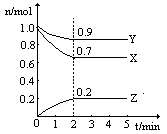
29.(12分)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为 。
(2)反应开始至2min,气体Z的平均反应速率为 。
|
|
(3)若X、Y、Z均为气体,反应达平衡时:
①此时体系的压强是开始时的 倍。
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为 反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时 (填增大、减小或相等)。
(4)此反应达平衡后,若只加大体系压强,Z的物质的量减少,若Y是气体,则X的聚集状态是 。
30.(15分)据下列信息完成所需回答的问题:
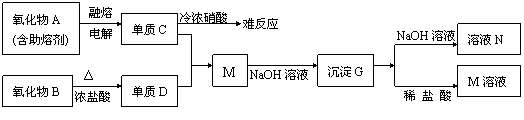
(1)A是 ,D是 ,G是 (填化学式)。
(2)元素C位于周期表中第 周期 族。
(3)写出下列反应的离子方程式:
B+浓盐酸 。
G+NaOH溶液 。
(4)单质C不与冷浓硝酸反应的原因是 。
(5)已知一定质量的B与足量的浓盐酸反应生成的D在标准状况下的体积为5.6L,求
被氧化的HCl的物质的量。(写出计算过程)
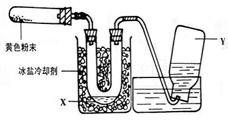 31.(20分)(Ⅰ)(10分)为了检验Pb(NO3)2热分解的产物,有人用示意图中的装置进行实验。(图中铁架台、铁夹和加热设备均略去)。
31.(20分)(Ⅰ)(10分)为了检验Pb(NO3)2热分解的产物,有人用示意图中的装置进行实验。(图中铁架台、铁夹和加热设备均略去)。
实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有少量液体X,集气瓶中收集到无色气体Y。(如图)回答下面问题:
(1)在装置中试管和U型管上的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,原因是 。
(2)液体X可能是 ;气体Y可能是 。
(3)导管口不再有气泡冒出时,停止反应,这时在操作上应注意 ,理由是 。
(4)用简单的实验证实(2)中的判断
①对X的判断 。
②对Y的判断(要求:怎样从水槽中取出集气瓶、实验方法、现象、结论)
。
(Ⅱ)(10分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
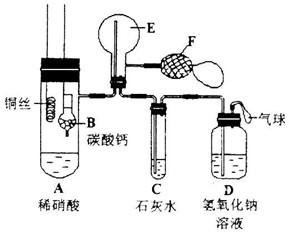
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为_______。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为_______________________________________________;
装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧并E内气体颜色加深,产生上述现象的原因是___________________________。
一段时间后,C中白色沉淀溶解,其原因是______________________。
(3)装置D的作用是________________________________________。
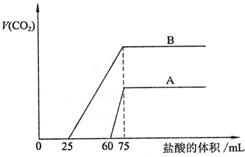 32.(15分)取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
32.(15分)取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)
,两种溶质的物质的量之比为 ;加盐酸后产生CO2体积的最大值为 mL。
(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)
,两种溶质物质的量之比为 ;加盐酸后产生CO2体积最大值 mL。
(3)通过计算求出原NaOH溶液的物质的量浓度。
高考理科综合测试(二)化学部分
参考答案
8.B9.C10.C11.A12.B13.D14.D15.B
![]() 29.(12分)(1)3X+Y 2Z
29.(12分)(1)3X+Y 2Z
(2)0.5mol/(L·min)
(3)①0.9 ②放,减小。
(4)固态或液态
30.(15分)(1)Al2O3;Cl2;Al(OH)3
(2)三,Ⅲ A
(3)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O (2分) Al(OH)3+OH-=AlO2-+2H2O
(4)铝遇到冷浓硝酸钝化
(5)0.5mol
31.(20分)
Ⅰ(10分)(1)NO2气体会损坏橡胶
(2)N2O4(答液态的NO2同样给分);O2
(3)先把导气管移出水面,然后熄灭火焰;防止水槽中的水反吸到U型管中。
(4)①在通风橱中取下U型管放置,观察到U型管中液体迅速消失,管中充满红棕色气体,证明X是液态N2O4。(其他合理答案同样给分)②在水槽,用玻璃片盖住集气瓶口,按住玻璃片,小心把集气瓶移出水面,正放在桌上,用带火星的木条插入瓶口,木条迅速燃烧,证明Y是O2 .
Ⅱ(10分)(1)用碳酸钙与稀硝酸反应产生的二氧化碳气赶走装置内的空气;
(2)![]() ;
;
CO2比空气重,从长管进入E,并没有把E中空气赶尽,致使部分NO先与未赶尽的空气生成少量红棕色NO2,当再从F鼓入空气时,E中有更多NO2生成,所以红棕色加深;
二氧化氮与水反应有硝酸生成,硝酸与碳酸钙反应使沉淀溶解;
(3)吸收NO、NO2、CO2尾气,防止污染大气。
②在水槽,用玻璃片盖住集气瓶口,按住玻璃片,小心把集气瓶移出水面,正放在桌上,用带火星的木条插入瓶口,木条迅速燃烧,证明Y是O2
32.(15分)(1)(6分) NaOH、Na2CO3 3∶1 33.6
(2)(6分)Na2CO3、NaHCO3 1∶1 112
(3)(4分)
解:图示表明,向溶液中滴加0.1mol/L的盐酸至不再放出CO2气体时,消耗盐酸的体积
为75mL。
所以原NaOH溶液的物质的量浓度为:
![]()
(其它多理解法可得分)