高考理科综合能力测试化学部分(一)
8.已知31g白磷变成红磷放出18.39kJ热量,下列两反应中,Q1和Q2的关系是
4P(白、s)+5O2(g)=2P2O5(s),△H=Q1kJ/mol
4P(红、s)+5O2(g)=2P2O5(s),△H=Q2kJ/mol
A.Q1>Q2 B.Q1=Q2 C.Q1<Q2 D.无法确定
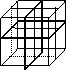 9.纳米材料的表面粒子占总粒子数比例极大,这是它有许多特殊
9.纳米材料的表面粒子占总粒子数比例极大,这是它有许多特殊
性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶
胞的大小和形状相同(如右图所示),则这种纳米颗粒的表面粒子数
与总粒子数的比值为
A.7:8 B.13:14 C.25:26 D.26:27
10.下列反应可用化学方程式SO2+Br2+2H2O == H2SO4+2HBr表示的有
①把SO2气体通入溴水中 ②把液溴加入到SO2的水溶液中 ③把硫酸与Na2SO3反应得到的气体通入溴水中 ④把浓硫酸与溴化氢混和加热得到的红色气体通入水中
A.①②④ B.①③④ C.①②③ D.①②③④
11.下表数据是对应物质的熔点(℃),据此作出的下列判断中,错误的是
| NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 801 | 920 | 1291 | 190 | -109 | 2073 | -57 | 1723 |
A.Al的化合物的晶体中有离子晶体
B.只有BCl3、干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
12.对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在溶液中是否存在的是
A.Br- B.SO42- C.H2SO3 D.NH4+
13.能正确表示下列化学反应的离子方程式是
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B.金属铝溶于盐酸中:Al+2H+=Al3++H2↑
C.硫化钠溶于水中:S2-+2H2O=H2S↑+2OH-
D.碳酸镁溶于硝酸中:CO32-+2H+=H2O+CO2↑
14.目前,科学界拟合成一种“二重构造”的球型分子,即把“足球型”的C60与“足球型”的Si60的分子进行重新构造,并使硅原子与碳原子以共价键结合,它的分子式为C60Si60。它的分子结构好似中国传统工艺品“镂雕”。下列叙述不正确的是
A.该物质的熔点比C60、Si60 均高 B.该物质形成的晶体属分子晶体
C.该物质分子中Si60被包裹在C60里面 D.该物质的相对分子质量为2400
15.由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生Cl2。下列关于混盐CsOCl2的有关判断不正确的是
A.该混盐与硫酸反应产生1molCl2时转移2NA个电子
B.该混盐的水溶液呈碱性
C.该混盐具有较强的氧化性
D.该混盐中的氯元素的化合价为+1和–1
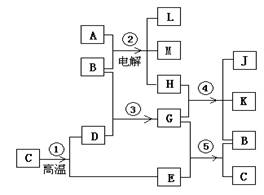 29.(12分)根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。
29.(12分)根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。
(1)单质L是 。
(2)化合物B是 。
(3)图中除反应①以外,还有两个用于工业生产的反应,是
和 (填代号)。
它们的化学反应方程式分别是:
,
。
30.(15分)致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的.人们曾采用过乙醚、NH3、CH3Cl等作致冷剂,但它们不是有毒,就是易燃、于是科学家根据元素性质的递变规律来开发新的致冷剂.
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期 > >H2O、HF;第三周期 SiH4>PH3> > .
(2)化合物的毒性:PH3>NH3 ; H2S H2O;CS2 CO2 ; CCl4 CF4 (选填>或<=)。
于是科学家们开始把注意力集中在含F、Cl的化合物上.
(3)已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新致冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的致冷剂氟里昂CF2Cl2终于诞生了,其它类似的还可以是 .
(4)然而,这种致冷剂造成了当今的某一环境问题是 .
但求助于周期表中元素及其化合物的 变化趋势来开发致冷剂的科学思维方法是值得借鉴的( ).
①毒性 ②沸点 ③易燃性 ④水溶性 ⑤颜色
(a)①②③ (b)②④⑤ (c)②③④
31.(15分)
(1)写出CO2和Na2O2反应的化学方程式:
。
(2)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗? ;
简要说明理由:
(3)该同学无法断定反应中是否有氧气生成,拟使用下列装置进行实验。
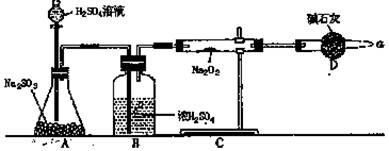
(33题图)
装置中B的作用是: ;
D的作用是:
(4)为确认反应产物,请完成下列实验表格:
| 操 作 | 现象及结论 |
| ①确认是否有氧气生成:
|
|
| ②确认是否有硫酸钠生成:
|
|
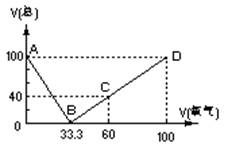 32.(20分)在标准状况下,将100mLH2S和O2混合气体点燃反应后恢复到原状况,发现随 混和气体中O2所占的体积V氧气的变化,反应后所得气体的总体积V总也不同,其关系式如下图所示(气体体积均在同温同压下测定)。请回答下列问题:
32.(20分)在标准状况下,将100mLH2S和O2混合气体点燃反应后恢复到原状况,发现随 混和气体中O2所占的体积V氧气的变化,反应后所得气体的总体积V总也不同,其关系式如下图所示(气体体积均在同温同压下测定)。请回答下列问题:
(1)写出图中B、C两点处的化学反应方程式:
B点的反应:
;
![]()
C点的反应:
。
(2)通过对图像的分析得出:
①当V总>40mL、②V总<40mL、③V总=40mL时气体的成分:
| AB段 | BD段 | |
| ①V总>40mL | ||
| ②V总<40mL | ||
| ③V总=40mL |
(3) 当V总=25mL时,求原混合气体中H2S和O2的体积各多少mL?
参考答案
8.C 9.D 10.D 11.B 12.B 13.A 14.C 15.A
29.(12分)(1)H2 (2)H2O (3)②,④
2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
2Ca(OH)2+2Cl2=Ca(OCl)2+CaCl2+2H2O
30.(15分)(1)CH4>NH3,H2S>HCl
(2)>,>,>
(3)CFCl3(或CF3Cl)
(4)使大气臭氧层出现空洞;a
31.(15分)
(1)2CO2+2Na2O2 2Na2CO2+O2(2分)
(2)合理(1分),SO2有还原性,Na2O2有氧化性,二者发生如下反应:SO2+Na2O2 Na2SO4(2分)
(3)除去水蒸气,干燥SO2,(2分)吸收未反应完的SO2避免污染空气,且防止空气中CO2和水蒸气进入(2分)
(4)(6分)
| 操 作 | 现象及结论 |
| ①用带火星的细木条靠近干燥管口a | 若细木条复燃则说明有O2生成,熄灭则无O2生成。 |
| ②将Na2O2反应后的固体物质溶于水配成溶液,先加盐酸,再加入氯化钡溶液。 | 若有沉淀生成证明有Na2SO4生成,无沉淀生成则无Na2SO4生成。 |
32.(20分)(1) B点的反应:2H2S+O2
== 2S+2H2O
C点的反应:2H2S+3O2 == 2SO2+2H2O
(2)
| AB段 | BD段 | |
| ①V总>40mL | H2S | O2与SO2 |
| ②V总<40mL | H2S或没有 | SO2或没有 |
| ③V总=40mL | H2S | SO2 |
(3)当V总=25mL时,从图中可以看出,在AB段与BD段均有可能。
①当在AB段时,H2S过量,反应后剩余的气体就是过量的H2S。设原混和物中O2的体积为xmL、H2S的体积为2x+ymL(ymL就是过量的H2S的体积),由题给条件可列出以下两式:
x+2x+y=100----------① ![]() (或直接写出x=25)-----②
(或直接写出x=25)-----②
解得:x=y=25,所以原混和气体中H2S的体积为75mL,O2的体积为25mL。
②当在BD段时,两者的反应可直接写成以下的形式:
xH2S+yO2
==![]() S+
S+![]() SO2+xH2O
SO2+xH2O
其中x+y=100,所以![]() =0.25,解得:x=y=50mL
=0.25,解得:x=y=50mL
所以原混和气体中两种气体的体积均为50mL。