高考能力测试步步高化学基础训练23
基础训练23 硝酸
(时间60分钟,赋分100分)
●训练指要
硝酸的性质,特别是浓硝酸的特性;硝酸的用途。
一、选择题(每小题3分,共45分)
1.(2002年全国高考题)化合价为n的某元素的硝酸盐的式量为x,其氢氧化物的式量为y,则n的值是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
2.久置的浓硝酸往往显黄色,其原因是
A.溶有Fe3+ B.溶有Br2
C.溶有NO2 D.溶有有机色素
3.硝酸与各种金属单质反应时,一般不会生成的物质是
A.NO B.NO2
C.NH4NO3 D.H2
4.现有下列物质:①氯水,②氨水,③浓硝酸,④氢氧化钠,⑤液溴。其中必须保存在棕色瓶里的是
A.全部 B.①③⑤
C.只有①③ D.①②④
5.为除去镀在铝表面的铜镀层可选用的试剂是
A.稀硝酸 B.浓硝酸
C.浓硫酸 D.浓盐酸
6.某金属与稀硝酸恰好完全反应生成NO,消耗金属和硝酸的物质的量之比为1∶3,则该金属可能是
A.Cu B.Ag
C.Al D.Fe
7.下列各组离子在溶液中能大量共存的是
A.Na+、H+、Cu2+、NO![]()
B.Na+、Fe2+、H+、NO![]()
C.NH![]() 、Cl-、SO
、Cl-、SO![]() 、OH-
、OH-
D.HCO![]() 、NH
、NH![]() 、Na+、OH-
、Na+、OH-
8.使3.2 g铜跟200 mL 2 mol·L-1的硝酸起反应,下列结论正确的是
A.有0.2 mol 电子发生转移
B.有0.033 mol硝酸被还原
C.有747 mL标准状况下的气体产生
D.生成的气体为NO2
9.往一由铁、铜组成的混合粉末中,加入一定量的稀HNO3,充分反应后,剩余金属m1 g,再向其中加入一定量的稀H2SO4,充分振荡后,余下金属m2 g,则m1与m2之间的关系为
A.m1>m2 B.m1<m2
C.m1=m2 D.无法确定
10.3.2 g铜与过量硝酸(8 mol·L-1,30
mL)充分反应,硝酸的还原产物为NO2和NO,反应后溶液中所含H+为a mol,则此时溶液中所含NO![]() 为
mol
为
mol
A.0.2+a B.0.1+a
C.0.05+a D.a
11.铜粉放入稀硫酸溶液中,加热后无明显变化,但加入某盐一段时间后,发现铜粉质量减少,溶液呈蓝色,则该盐可能是
A.FeCl3 B.Na2CO3
C.KNO3 D.FeSO4
12.取三张蓝色石蕊试纸放在玻璃棒上,然后分别滴加65%的HNO3,98.3%的H2SO4和新制氯水,三张试纸最后呈现的颜色是
A.白、红、白 B.红、黑、红
C.红、红、红 D.白、黑、白
13.能证明浓HNO3氧化性比浓H2SO4氧化性强的事实是
A.浓HNO3光照或加热时放出氧气
B.浓HNO3与浓盐酸可配制“王水”
C.浓HNO3与硫反应可生成H2SO4
D.浓HNO3有多种还原产物
14.已知3NO2+H2O===2HNO3+NO,NO2+NO+2NaOH===2NaNO2+H2O。将20 mL NO和30 mL NO2混合气体缓慢通入足量NaOH溶液后,最后剩余的气体体积最少是
A.30 mL B.10 mL
C.3.33 mL D.0 mL
15.在下列反应中,浓硝酸既表现氧化性又表现酸性的是
A.CuO+浓HNO3 B.C+浓HNO3
C.FeO+浓HNO3 D.H2S+浓HNO3
二、非选择题(共55分)
16.(8分)某学生两次分别用2.6 g锌和硝酸溶液进行反应,两次所用的硝酸溶液中均含有6.3 g HNO3,但浓度不同,均恰好完全反应。又已知第一次实验中有1/5的HNO3被还原,第二次实验中只有1/10的HNO3被还原。试写出相应的化学方程式:
第一次实验:
第二次实验:
17.(8分)以铜屑和稀HNO3为主要原料制取Cu(NO3)2·6H2O 晶体,有下列两种途径:
(1)Cu![]() Cu(NO3)2
Cu(NO3)2![]() Cu(NO3)2·6H2O
Cu(NO3)2·6H2O
(2)Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2![]() Cu(NO3)2·6H2O
Cu(NO3)2·6H2O
试回答:选用方法 好,原因 。
18.(6分)现有A、B、C、D四种气体,都是无机物,能发生下列反应:
A+D![]() E+H2O
E+H2O
E+O2![]() D
D
C+D![]() B+F
B+F
B+O2![]() C
C
其中:C为红棕色,D能使石灰水变浑浊,E常温下是固体,F是一种酸酐。
(1)写出这四种气体的化学式:A ,B ,C ,D 。
(2)写出C+D![]() B+F反应方程式:
。
B+F反应方程式:
。
19.(15分)一包白色固体,可能由NaOH、NaCl、Na2CO3、Na2SO4、NaNO3、CuSO4中的一种或几种组成,为判断其组成,作了如下实验:
①取少量固体溶于水,得到浅蓝色溶液;
②取少量固体,加入浓硫酸和铜屑,微热后有红棕色气体产生;
③取少量固体,加入浓硫酸,微热时有气体产生,该气体不能使澄清石灰水变浑浊;
④取少量固体,溶于水后,加过量硝酸钡溶液,有白色沉淀生成,再继续滴加硝酸银溶液,沉淀又增加。
(1)该样品中一定含有的物质是 ,一定不含的物质是 ;可能含有的物质是 。
(2)写出②和③实验中有关反应的化学方程式:
②中
③中
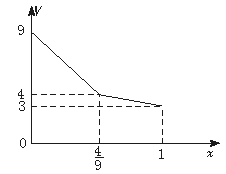
20.(9分)现有NO2与空气的混合气体共9 L,其中NO2的体积分数为x,试求混合气体缓缓通过盛有足量水的洗气瓶后所得气体的体积V(同温同压,用x表示),并在下图的
V—x坐标上作出相应的曲线(不考虑N2O4。空气的成分以V(N2)∶V(O2)=4∶1计算)。
21.(9分)2.24 g铁与100 mL稀硝酸混合后充分反应,产生气体为NO,铁、硝酸均无剩余。向反应后的溶液中加入50 mL 0.2 mol·L-1的碘化钾溶液,恰好将溶液中的Fe3+全部还原,求原硝酸溶液的物质的量浓度。
高考能力测试步步高化学基础训练23答案
一、1.A 2.C
3.解析:HNO3有强氧化性主要体现在![]() 上,因此在反应中是
上,因此在反应中是![]() 的化合价降低。
的化合价降低。
答案:D
4.C
5.解析:常温下浓HNO3能溶解铜,与铝产生“钝化”。
答案:B
6.解析:Fe与稀HNO3反应,部分生成Fe(NO3)2,部分生成Fe(NO3)3。
答案:D
7.A 8.BC
9.解析:加入一定量的稀H2SO4后因溶液中含有NO![]() ,则有3Cu+8H++2NO
,则有3Cu+8H++2NO![]() ===3Cu2++2NO+4H2O。
===3Cu2++2NO+4H2O。
答案:A
10.B 11.AC 12.D 13.C 14.C 15.C
二、16.(1)4Zn+10HNO3===4Zn(NO3)2+N2O↑+5H2O
(2)4Zn+10HNO3===4Zn(NO3)2+NH4NO3+3H2O
17.(2) 消耗的HNO3量少,参加反应的HNO3全部转变为Cu(NO3)2,并且无污染气NO产生
18.(1)H2S NO NO2 SO2
(2)NO2+SO2===NO+SO3
19.(1)CuSO4、NaNO3、NaCl Na2CO3、NaOH Na2SO4
(2)②中:4NaNO3+Cu+4H2SO4(浓) ![]() 4NaHSO4+Cu(NO3)2+2NO2↑+2H2O
4NaHSO4+Cu(NO3)2+2NO2↑+2H2O
③中:NaNO3+H2SO4(浓)![]() NaHSO4+HNO3↑
NaHSO4+HNO3↑
NaCl+H2SO4(浓)![]() NaHSO4+HCl↑
NaHSO4+HCl↑
20.当0≤x≤![]() ,V=9-
,V=9-![]() x
x
当![]() ≤x≤1,V=
≤x≤1,V=![]()
V对x的关系见下图
21.1.2 mol·L-1