高考能力测试步步高化学基础训练24
基础训练24 化学反应速率
(时间60分钟,赋分100分)
●训练指要
本训练点包括:化学反应速率的概念及表示方法;反应进行快慢的判断;影响化学反应速率的因素及有关计算。
一、选择题(每小题5分,共45分)
1.(2001年高考理综题)将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g) ![]() 2C(g)
2C(g)
若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
②用物质B表示的的反应的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为70% ④2 s时物质B的浓度为0.7 mol·L-1,其中正确的是
A.①③ B.①④
C.②③ D.③④
2.把下列四种X溶液,分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,并加水稀释到50 mL。此时X和盐酸缓慢地进行反应,其中反应速率最快的是
A.20 mL 3 mol·L-1 B.20 mL 2 mol·L-1
C.10 mL 4 mol·L-1 D.10 mL 2 mol·L-1
3.已知4NH3+5O2===4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、
v(H2O)表示,则正确的关系是
A.![]() v(NH3)=v(O2)
v(NH3)=v(O2)
B.![]() v(O2)=v(H2O)
v(O2)=v(H2O)
C.![]() v(NH3)=v(H2O)
v(NH3)=v(H2O)
D.![]() v(O2)=v(NO)
v(O2)=v(NO)
4.将A,B置于容积为2 L的密闭容器中,发生如下反应:4A(g)+B(g)![]()
2C(g),反应进行到4 s末,测得A为0.5 mol,B为0.4 mol,C为0.2 mol,用反应物浓度的减少来表示该反应的速率可能为
A.0.025 mol·L-1·s-1
B.0.0125 mol·L-1·s-1
C.0.05 mol·L-1·s-1
D.0.1 mol·L-1·s-1
5.在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)(mol·L-1·s-1)表示且v(A)、v(B)、v(C)之间有以下关系:v(B)=3v(A),3v(C)=2v(B)。则此反应可表示为
A.2A+3B![]() 2C
2C
B.A+3B![]() 2C
2C
C.3A+B![]() 2C
2C
D.A+B![]() C
C
6.反应4A(g)+5B(g)===4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,
C的物质的量增加了0.30 mol。下列叙述正确的是
A.A的平均反应速率是0.010 mol·L-1·s-1
B.容器中含D物质的量至少为0.45 mol
C.容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
D.容器中A的物质的量一定增加了0.30 mol
7.在2 L密闭容器中充入2
mol SO2和一定量O2,发生2SO2+O2![]() 2SO3反应,进行到4 min时,测得n(SO2)=0.4
mol,若反应进行到2 min时,容器中n(SO2)为
2SO3反应,进行到4 min时,测得n(SO2)=0.4
mol,若反应进行到2 min时,容器中n(SO2)为
A.1.6 mol B.1.2 mol
C.大于1.6 mol D.小于1.2 mol
8.在锌片和盐酸的反应中,加入下列试剂,可使生成氢气的速率变慢的是
A.硫酸铜晶体 B.水
C.氯化钡晶体 D.醋酸钾晶体
9.反应速率v和反应物浓度的关系是用实验方法测定的,化学反应H2+Cl2===2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定之。
| c(H2)(mol·L-1) | c(Cl2)(mol·L-1) | v(mol·L-1·s-1) | |
| ① | 1.0 | 1.0 | 1.0k |
| ② | 2.0 | 1.0 | 2.0k |
| ③ | 2.0 | 4.0 | 4.0k |
由此可推得,m、n值正确的是
A.m=1,n=1 B.m=![]() ,n=
,n=![]()
C.m=![]() ,n=1 D.m=1,n=
,n=1 D.m=1,n=![]()
二、非选择题(共55分)
10.(12分)(2001年上海高考题)某化学反应2A![]() B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20 min时间内平均速率为 mol·(L·min)-1。
(2)在实验2中A的初始浓度C2= mol·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填“>”“=”或“<”=,且C3 1.0 mol·L-1(填“>”“=”或“<”=。
(4)比较实验4和实验1,可推测该反应是 反应(选填“吸热”或“放热”)。理由是 。
11.(8分)根据化学方程式2N2O![]() 2N2+O2,填充表中①、②、③、④空栏处测定反应速率的实验数据和计算结果。
2N2+O2,填充表中①、②、③、④空栏处测定反应速率的实验数据和计算结果。
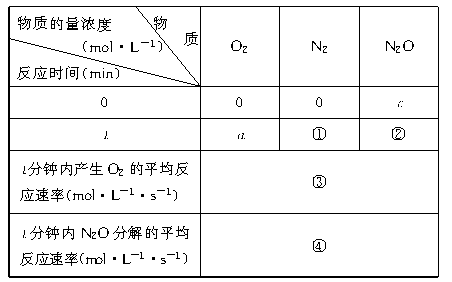
①
②
③
④
12.(5分)反应A+3B==2C+2D在四种不同情况下的反应速率分别为①v(A)=0.15 mol·L-1·s-1;②v(B)=0.6mol·L-1·s-1;③v(C)=0.4 mol·L-1·s-1;④v(D)=0.45 mol·L-1·s-1。该反应进行的快慢顺序为 。
13.(12分)可逆反应aA(g)+bB(g)![]() cC(g)+dD(g),取a mol A和b mol B置于V L容器中,1
min后,测得容器内A的浓度为x mol·L-1,这时B的浓度为 mol·
cC(g)+dD(g),取a mol A和b mol B置于V L容器中,1
min后,测得容器内A的浓度为x mol·L-1,这时B的浓度为 mol·
L-1,C的浓度为 mol·L-1。这段时间内反应的平均速率若以物质A的浓度变化来表示,应为 。
14.(18分)现有一份“将二氧化硫转化为硫酸铵”的资料,摘录如下:
一个典型实例:初步处理后的废气含0.20%的二氧化硫和10%的氧气(体积分数)。在
400℃时废气以5 m3·h-1的速率通过五氧化二钒催化剂层与20 L·h-1的速率的氨气混合,再喷水,此时气体温度由400℃降至200℃,在热的结晶装置中得到硫酸铵晶体(气体体积均已折算为标准状况)。
利用上述资料,用氨来除去工业废气中的二氧化硫,回答下列问题:
(1)按反应中的理论值,二氧化硫和氧气的物质的量之比为2∶1,该资料中这个比值是 ,简述不采用2∶1的理由是 。
(2)通过计算,说明为什么废气以5 m3·h-1的速率与20 L·h-1速率的氨气混合?
(3)若某厂每天排放1×104 m3这种废气,按上述方法该厂每月(按30天计)可得硫酸铵多少吨?消耗氨气多少吨?
高考能力测试步步高化学基础训练24答案
一、1.B 2.A
3.解析:v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6。
答案:D
4.BC 5.B 6.B 7.D 8.BD
9.解析:由①②组数据解得m=1,由②③组数据解得n=![]() 。
。
答案:D
二、10.(1)0.013 (2)1.0 催化剂 (3)> >
(4)吸热 温度升高时,平衡向右移动
11.①2a ②c-2a ③a/t ④2a/t
12.④>③=②>①
13.![]()
![]() (
(![]() -x)mol·L-1·min-1
-x)mol·L-1·min-1
14.(1)1∶50 根据勒夏特列原理,通入过量而廉价的氧气,可提高SO2的转化率
(2)废气中每小时排出的SO2的体积为:1000 L·m-3×5m3×0.2%=10 L,每小时氨与废气中SO2混合的体积比为2∶1,恰好可全部转化为(NH4)2SO4。
(3)SO2 ~ 2NH3 ~ (NH4)2SO4
![]() mol
mol
![]() mol
mol
![]() mol
mol
故可得(NH4)2SO4:![]() mol×132 g·mol-1×10-6t·g-1=3.54
t
mol×132 g·mol-1×10-6t·g-1=3.54
t
消耗氨气:![]() mol×2×17 g·mol-1×10-6 t·g-1=0.91 t
mol×2×17 g·mol-1×10-6 t·g-1=0.91 t