高考能力测试步步高化学基础训练25
基础训练25 化学平衡 影响化学平衡的条件
(时间60分钟,赋分100分)
●训练指要
本训练点包括:化学平衡的标志、特征;等效平衡的特点和应用;化学平衡的有关计算及化学平衡常数;勒夏特列原理与化学平衡移动。
一、选择题(每小题5分,共45分)
1.(2003年春季高考题)反应:A(g)+3B(g)![]() 2C(g),ΔH<0达平衡后,将气体混合物的温度降低,下列叙述中正确的是
2C(g),ΔH<0达平衡后,将气体混合物的温度降低,下列叙述中正确的是
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率都变小,平衡向正反应方向移动
D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动
2.(2001年全国理综题)在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
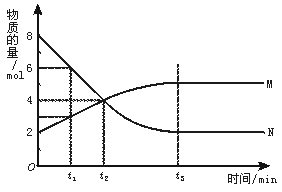
A.反应的化学方程式为:2M![]() N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
3.在一定温度下的定容密闭容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g) ![]() C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体的总物质的量
4.在一个容积为V L的密闭容器中放入2 L A(g)和1 L B(g),在一定条件下发生下列反应:
3A(g)+B(g) ![]() nC(g)+2D(g)
nC(g)+2D(g)
达到平衡后,A物质的量浓度减少![]() ,混合气体的平均摩尔质量增大
,混合气体的平均摩尔质量增大![]() ,则该反应的化学方程式中n的值是
,则该反应的化学方程式中n的值是
A.1 B.2 C.3 D.4
5.在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1
mol H2和2 mol Br2达到平衡后,生成了a mol HBr。在相同条件下,若起始时加入的H2、Br2、HBr分别为x mol、y mol、z
mol(均不为0)且保持平衡时,各组分含量都不变。以下推断中一定正确的是
2HBr(g),已知加入1
mol H2和2 mol Br2达到平衡后,生成了a mol HBr。在相同条件下,若起始时加入的H2、Br2、HBr分别为x mol、y mol、z
mol(均不为0)且保持平衡时,各组分含量都不变。以下推断中一定正确的是
①x,y,z应满足的关系为:4x+z=2y
②达到平衡时HBr的物质的量为![]() a mol
a mol
③达到平衡时HBr的物质的量为a mol
④x、y、z应满足的关系为x+y=z
A.①② B.②③ C.③④ D.①②③
6.已知HF气体中存在下列平衡:
2(HF)3![]() 3(HF)2 (HF)2
3(HF)2 (HF)2![]() 2HF
2HF
若平衡时混合气体的平均摩尔质量为42 g·mol-1,则(HF)3的体积分数为
A.<10% B.=10%
C.>10% D.≥10%
7.在一个密闭容器中充入1 mol CO2和3 mol H2,在850℃时,气体混合物达到下式所示平衡:CO2+H2![]() CO+H2O。已知达到平衡时生成0.75 mol CO,那么当H2改为9 mol,在上述条件下平衡时生成CO与水蒸气的物质的量之和可能为
CO+H2O。已知达到平衡时生成0.75 mol CO,那么当H2改为9 mol,在上述条件下平衡时生成CO与水蒸气的物质的量之和可能为
A.1.2 mol B.1.5 mol
C.1.8 mol D.2.5 mol
8.在一个固定容积的密闭容器中,放入3 L X(g)和2 L Y(g),在一定条件下发生下列反应:4X(g)+3Y(g) ![]() 2Q(g)+nR(g)。达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减少1/3,则该反应方程式中的n值是
2Q(g)+nR(g)。达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减少1/3,则该反应方程式中的n值是
A.4 B.5 C.6 D.7
9.有一处于平衡状态的反应:X(s)+3Y(g) ![]() 2Z(g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加正催化剂 ⑥分离出Z
A.①③⑤ B.②③⑤
C.②③⑥ D.②④⑥
二、非选择题(共55分)
10.(12分)在真空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应:
PH4I(s)![]() PH3(g)+HI(g)
PH3(g)+HI(g)
4PH3(g)![]() P4(g)+6H2(g)
P4(g)+6H2(g)
2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
以上三反应建立平衡后,测得HI为b mol,I2(g)为c mol,H2为d mol。求:
(1)平衡后,容器内P4(g)和PH3(g)的物质的量(用代数式表示) ;
(2)a,b,c三者的关系为a> (填含b,c的代数式);
(3)b,c,d三者的关系为b> (填含c,d的代数式)。
11.(12分)在120℃时分别进行如下四个反应:
A.2H2S+O2===2H2O+2S
B.2H2S+3O2===2H2O+2SO2
C.C2H4+3O2===2H2O+2CO2
D.C4H8+6O2===4H2O+4CO2
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合关系式d前=d后和p前>p后的是 ;符合关系式d前=d后和p前=p后的是 (请填写反应的代号)。
(2)若反应在压强恒定容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后的是 ;符合d前>d后和V前>V后的是 (请填写反应的代号)。
12.(9分)已知t℃,p kPa时,在容积为V L密闭容器内充有1 mol A和1
mol B。保持恒温恒压,使反应A(g)+B(g) ![]() C(g)达到平衡时,C的体积分数为40%。试回答有关问题:
C(g)达到平衡时,C的体积分数为40%。试回答有关问题:
(1)欲使温度和压强在上述条件下恒定不变,在密闭容器内充入2 mol A和2 mol B,则反应达到平衡时,容器的容积为 ,C的体积分数为 。
(2)若另选一容积固定不变的密闭容器,仍控制温度为t℃,使1 mol A和1 mol B反应达到平衡状态时,C的体积分数仍为40%,则该密闭容器的容积为 。
13. (10分)对可逆反应aA(g)+bB(g)![]() cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系:
cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系:![]() =K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关。现有反应:CO(g)+H2O(g)
=K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关。现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)+Q。在850℃时,K=1。
CO2(g)+H2(g)+Q。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K 1(填“大于”“小于”或“等于”)。
(2) 850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向 (填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
(3)在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a b(填“大于”“小于”或“等于”)。
14.(12分)(2002年上海高考题)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)===CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
a.容器中压强不变
b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)
d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O)。试判断此时的温度。
高考能力测试步步高化学基础训练25答案
一、1.C 2.D 3.BC 4.A 5.A 6.C 7.C 8.C 9.C
二、10.(1)n(P4)=![]() (d-c)
mol
(d-c)
mol
n(PH3)=[![]() (4c-d)+b]
mol
(4c-d)+b]
mol
(2)b+2c (3) ![]() (d-4c)
(d-4c)
11.(1)B C (2)D A
12.(1)![]() V L 40% (2)
V L 40% (2)![]() V L
V L
13.(1)小于 (2)①逆反应 ②x<3.0 (3)小于
14.(1)K=![]()
(2)吸热 (3)bc (4)830