高考能力测试步步高化学基础训练26
基础训练26 电离平衡
(时间60分钟,赋分100分)
●训练指要
本训练点包括:强、弱电解质的概念及电离方程式的书写;弱电解质的电离平衡;电离平衡常数。
一、选择题(每小题5分,共45分)
1.(2001年全国高考题)在含有酚酞的0.1 mol·L-1氨水中加入少量的NH4Cl晶体,则溶液颜色
A.变蓝色 B.变深
C.变浅 D.不变
2.当不考虑水的电离时,在氢硫酸溶液中,下列的离子浓度关系中正确的是
A.c(H+)=c(HS-)+2c(S2-)
B.c(H+)=c(HS-)+c(S2-)
C.2c(S2-)=c(H+)
D.c(S2-)=c(HS-)
3.在无土栽培中,需配制一定量含50 mol NH4Cl,24 mol K2SO4的营养液。若用KCl,NH4Cl和(NH4)2SO4三种固体为原料来配制,三者的物质的量依次是(单位为mol)
A.2,64,24 B.48,2,24
C.32,50,12 D.16,50,24
4.在浓度均为1 mol·L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,若测得其中c(NH![]() )分别为a、b、c(mol·L-1),则下列判断正确的是
)分别为a、b、c(mol·L-1),则下列判断正确的是
A.a=b=c B.c>a>b
C.b>a>c D.a>c>b
5.甲酸的下列性质中可以证明它是弱电解质的是
A.1 mol·L-1的甲酸溶液的c(H+)约为0.01 mol·L-1
B.甲酸与水以任意比例互溶
C.10 mL 1 mol·L-1甲酸恰好与10 mL 1 mol·L-1NaOH溶液完全反应
D.在相同条件下,甲酸的导电性比一元强酸溶液的弱
6.用水稀释0.1 mol·L-1氨水时,溶液中随着水量的增加而减小的是
A.c(OH-)/c(NH3·H2O)
B.c(NH3·H2O)/c(OH-)
C.c(H+)和c(OH-)的乘积
D.OH-的物质的量
7.下列各电离方程式中书写正确的是
A.CH3COOH![]() H++CH3COO-
H++CH3COO-
B.KHSO4![]() K++H++SO
K++H++SO![]()
C.Al(OH)3![]() Al3++3OH-
Al3++3OH-
D.NaH2PO4![]() Na++H2PO
Na++H2PO![]()
8.当溶液中HS-+H2O![]() S2-+H3O+达到平衡时,欲使c(S2-)增大,应加入
S2-+H3O+达到平衡时,欲使c(S2-)增大,应加入
A.Cu2+ B.CO![]()
C.H2O D.HCl
9.在RNH2·H2O![]() RNH
RNH![]() +OH-形成的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施是
+OH-形成的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施是
A.通入HCl B.加少量NaOH固体
C.加水 D.升温
二、非选择题(共55分)
10.(12分)用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.1 mol·L-1的溶液 100 mL;②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;②分别取这两种溶液各10 mL,加水稀释为100 mL;③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是 。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)。
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
a.装HCl溶液的试管中放出H2的速率快;
b.装HA溶液的试管中放出H2的速率快;
c.两个试管中产生气体速率一样快:
(3)请你评价乙方案中难以实现之处和不妥之处。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
11.(9分)如下图,在一烧杯中盛有200 mL 0.1 mol·L-1的H3PO4溶液,同时一光滑小球悬浮在液体中间。
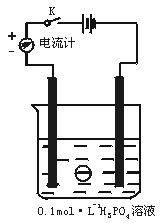
(1)合上电键K时,电流计指针向 边偏转。
(2)向烧杯里逐滴滴入0.4 mol·L-1的Ba(OH)2溶液至刚好完全反应,可观察到的现象有:
① ,② ,③ 。
(3)磷酸可用磷矿石[Ca3(PO4)2]来制取,写出该反应的化学方程式:
12.(12分)已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度大于第二步电离程度,第二步电离程度远大于第三步电离程度……
今有HA、H2B、H3C三种一元、二元、三元弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
①HA+HC2-(少量)===A-+H2C-
②H2B(少量)+2A-===B2-+2HA
③H2B(少量)+H2C-===HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中酸性最强的是 。
(2)A-、B2-、C3-、HB-、H2C-、HC![]() 种离子中,最易结合质子的是
,最难结合质子的是
。
种离子中,最易结合质子的是
,最难结合质子的是
。
(3)判断下列反应的离子方程式中正确的是(填写标号) 。
A.H3C+3A-===3HA+C3-
B.HB-+A-===HA+B2-
C.H3C+B2-===HB-+H2C-
(4)完成下列反应的离子方程式。
A.H3C+OH-(过量) ;
B.HA(过量)+C3- 。
13.(8分)在稀氨水中存在平衡:NH3+H2O![]() NH
NH![]() +OH-,如进行下列操作,则NH3、NH
+OH-,如进行下列操作,则NH3、NH![]() 、H+、OH-浓度如何变化?试用“增大”“减小”“不变”填写。
、H+、OH-浓度如何变化?试用“增大”“减小”“不变”填写。
(1)通适量HCl气体时,c(NH3) ,c(H+) 。
(2)加入少量NaOH固体时,c(NH![]() )
,c(OH-)
。
)
,c(OH-)
。
(3)加入NH4Cl晶体时,c(NH![]() )
,c(OH-)
。
)
,c(OH-)
。
14.(8分)在a、b两支试管中,分别装上形态相同、质量相等的一颗锌粒,然后向两支试管中分别加入相同物质的量、相同体积的稀盐酸和稀醋酸。填写下列空白:
(1)a、b两支试管中的现象:相同点是 ;不同点是 。原因是 。
(2)a、b两支试管中生成气体的体积开始时是a 于b,反应完毕后生成气体的总体积是a b,原因是 。
15.(6分)为测定人呼出气体中二氧化碳的含量,将1000 mL呼出的气体通入50.0 mL氢氧化钡溶液中,使其完全吸收,过滤后取20.0 mL澄清溶液,用0.100 mol·L-1盐酸滴定,当耗去20.4 mL盐酸时恰好完全反应。另取20.0 mL原氢氧化钡溶液,用同种盐酸滴定,耗去36.4 mL盐酸时,恰好反应完全。试计算人呼出气体中二氧化碳的体积百分含量(气体体积在标准状况下测定)。
高考能力测试步步高化学基础训练26答案
一、1.解析:c(NH![]() )增大,平衡逆向移动。
)增大,平衡逆向移动。
答案:C
2.A 3.B 4.B 5.AD 6.B 7.A 8.B 9.D
二、10.(1)100 mL容量瓶
(2)> b
(3)配制pH=1的HA溶液难以实现,不妥之处在于加入的锌粒难以做到表面积相同。
(4)配制NaA溶液,测其pH>7,即证明HA是弱电解质。
11.(1)右
(2)①小球下沉到烧杯底部 ②产生白色沉淀 ③电流计指针偏转幅度不断变小,最后指针回到中央
(3)Ca3(PO4)2+3H2SO4===2H3PO4+3CaSO4
12.(1)H2B (2)C3- HB- (3)BC
(4)H3C+3OH-===C3-+3H2O
2HA+C3-===2A-+H2C-
13.(1)减小 增大 (2)减小 增大 (3)增大 减小
14.(1)都产生气泡,Zn溶解 a产生气泡、Zn溶解速度都快 HCl完全电离,HCl中的c(H+)大于CH3COOH中的c(H+)
(2)大 等于 a中c(H+)大于b中的c(H+),而酸的总量相等
15.4.48%