高考化学模拟试卷6
第I卷(选择题 共46分)
可能用到的相对原子质量: H—1 O—16 N—14 S—32 Na—23 Al—27 Cu—64
一、选择题(本题包括8小题,每小题2分,共16分。每小题只有一个选项符合题意)
1.氮化硅陶瓷是一种超硬耐磨物质,可用于制造高性能柴油机发动机部件,它属于 ( )
A.金属材料 B.无机非金属材料 C.复合材料 D.功能高分子材料
2.下列仪器①天平 ②容量瓶 ③蒸馏烧瓶 ④漏斗 ⑤分液漏斗 ⑥滴定管,其中常用于物质分离的是 ( )
A.①③④ B.①②⑥ C.③④⑤ D.③④⑥
3.NA表示阿伏加德罗常数,下列说法中正确的是 ( )
A.1 mol D2O中所含质子数为12NA
B.1 L 0.5 mol/L的(NH4)2SO4溶液中含有NA个NH4+
C.在25℃,1.01×105 Pa条件下,1 mol Na2O2固体溶于足量水中,产生11.2 L O2
D.1 mol氦气分子中含NA氦原子
4.下列说法正确的是 ( )
A.用结晶法除去硝酸钾中混有的少量氯化钠
B.用湿润的pH试纸测定溶液的pH
C.用点燃的方法除去二氧化碳中混有的少量一氧化碳
D.在氢氧化铁胶体中加入过量的盐酸最终会产生沉淀
5.六氧化四磷的分子结构中只有单键,且每个原子的最外层都满足8电子结构,则该分子中含有的共价键的数目是 ( )
A.10 B.12 C.24 D.28
6.YBa2Cu3Ox是最近合成的高温超导物质,它可由Y2O3、BaCO3和CuO为原料经研磨烧结而成(烧结过程中各元素的化合价不变)。0.5 mol YBa2Cu3Ox中含有氧原子的物质的量为 ( )
A.0.5 mol B.3.25 mol C.4 mol D.5.25 mol
7.分别处于元素周期表第二、三周期的主族元素A和B,它们离子的电子层结构相差两层。已知A处于第m主族,B处于第n主族,且A只有正化合价。则A、B两元素的原子序数分别为 ( )
A.m、n B.m-2、10-n C.m+2、n+10 D.m+8、n+10
8.有m1 g KCl饱和溶液,其溶质的质量分数为c1%,改变温度或蒸发水后析出m3 g KCl晶体,母液质量为m2 g,其溶质的质量分数为c2%。则下列关系一定正确的是 ( )
A.c1一定大于c2 B.m1-m3 = m2 C.m1c1-m2c2 = 100m3
D.原条件下KCl的溶解度小于c1 g
二、选择题(本题包括10小题,每小题3分,共30分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选2个且都正确的给3分,但只要选错一个,该小题就为0分。)
9.能说明醋酸是弱电解质的是 ( )
A.醋酸钠溶液呈碱性
B.用食醋可以除热水瓶内的水垢
C.用浓硫酸和醋酸钠固体共热可制得醋酸
D.pH=2的醋酸溶液稀释1000倍后,pH小于5
10.下列有关化工生产的叙述正确的是 ( )
A.氯碱工业中,阳极发生的反应是:2H++2e = H2↑
B.粗铜精炼电解池中,粗铜作阳极
C.硫酸工业中,二氧化硫经接触氧化生成三氧化硫后,在吸收塔中用水吸收
D.硅酸盐工业中,制玻璃、水泥及陶瓷的主要原料都是石灰石和粘土
11.下列用来表示物质变化的化学用语中,不正确的是 ( )
A.钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-= 4OH-
B.明矾水解的离子方程式:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
C.氢氧化钙溶液与碳酸氢钠溶液混合:HCO3-+OH-= CO32-+H2O
D.用碳酸钠吸收少量二氧化硫:2CO3 2-+SO2+H2O = 2HCO3-+SO32-
12.下列说法正确的是 ( )
A.在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ能量,则C的燃烧热为110.5 kJ/mol
B.在101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,H2的燃烧热为 -285.8 kJ/mol
C.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸的起始温度、NaOH起始温度和反应后终止温度
D.在稀溶液中:H+(aq)+ OH-(aq) = H2O;△H=-57.3 kJ/mol。若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
13.有人曾建议用AG表示溶液的酸度,AG定义为AG=lg[![]() ]。常温下,在AG=12的某无色溶液中能大量共存的离子组是 ( )
]。常温下,在AG=12的某无色溶液中能大量共存的离子组是 ( )
A.Na+、K+、NO3-、I- B.K+、Cl-、NH4+、HCO3-
C.Na+、Al3+、SO42-、Br- D.K+、Cu2+、Cl-、NO3-
14.向某溶液中加入含Fe2+的溶液后,无明显变化。当再滴加几滴新制氯水后,混合液变成血红色,则下列结论中错误的是 ( )
A.该溶液中一定含有SCN- B.氧化性:Fe3+>Cl2
C.Fe2+与SCN-不能形成红色物质 D.Fe2+被氯水氧化为Fe3+
15.下列叙述正确的是 ( )
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.相同物质的量浓度,相同体积的强酸与强碱溶液混合,反应后pH=7
C.原子失去电子所形成的离子,一定具有稀有气体的电子层结构
D.某元素在化学变化中由化合态变为游离态,不能确定该元素一定被还原
16.在容积不变的密闭容器中,一定条件下发生反应:2A![]() B(g)+C(s),且达到化学平衡。当升高温度时,其容器内气体的密度增大,则
( )
B(g)+C(s),且达到化学平衡。当升高温度时,其容器内气体的密度增大,则
( )
A.若正反应是吸热反应,则A为非气态
B.若正反应是放热反应,则A为气态
C.在平衡体系中加入少量C,该平衡向逆反应方向移动
D.压强对该平衡的移动无影响
17.在一定条件下,下列药物的主要成分都能发生①取代反应 ②加成反应 ③水解反应 ④中和反应 四种反应的是 ( )
A.维生素![]()
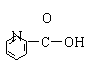
 B.阿斯匹林
B.阿斯匹林![]()
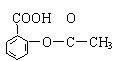

C.芬必得![]()
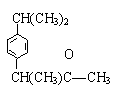
 D.扑热息痛
D.扑热息痛![]()
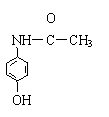

18.常温下用蒸馏水稀释0.1 mol/L的氨水时,溶液中随水的量增加而减少的是 ( )
A.OH-物质的量 B.NH3·H2O和NH4+的物质的量之和
C.c (H+)和c(OH-)的乘积 D.c(NH3·H2O)/c(OH-)
第II卷 (非选择题 共54分)
三、(本题包括2小题,共15分)
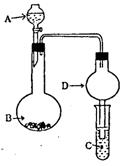 19.(6分)在如图所示的实验装置中,当A、B、C分别是下列不同组合的物质时,请根据要求回答有关问题:
19.(6分)在如图所示的实验装置中,当A、B、C分别是下列不同组合的物质时,请根据要求回答有关问题:
(1)当A为醋酸,B为贝壳,C为C6H5ONa溶液时,
小试管中的现象是__________,小试管中发生
反应的化学方程式是____________________
_____________________________________。
(2)当A为食盐水,B为电石,C为酸性KMnO4
溶液时,小试管中的现象是____________,
A和B反应的化学方程式为:___________
___________________________________。
(3)当A为浓氨水,B为生石灰,C为AlCl3溶液时,小试管中的现象是____________
_____________,小试管中发生反应的离子方程式为_______________________。
20.(9分)下图是某同学设计的NH3催化氧化并检验反应生成的酸性物质的简易装置(图中必要的铁架台.铁夹.微型酒精灯等均已略去)。已知:NO2+NO+2NaOH = 2NaNO2+ H2O,实验中所选用的试剂不超出下列范围,且不得重复使用。
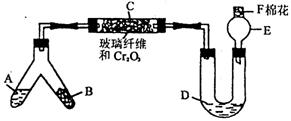
①NH4Cl和Ca(OH)2的混合物 ②浓氨水 ③NaOH固体 ④KClO3和MnO2的混合物
⑤6 mol/L NaOH溶液 ⑥0.5 mol/L NaOH溶液 ⑦酚酞试液 ⑧碱石灰 ⑨浓H2SO4
⑩CuO
试回答下列问题:
(1)叉型管中液态物质A是(填代号)_______,固体物质B是(填代号)________。
(2)C处发生反应的化学方程式是_______________________________。
(3)混合物D是为了检验酸性物质的生成而放入的,其组成是(填代号)______;实验过程中现象是__________________。
(4)E处球形玻璃管的作用是_____________________________。
(5)F处的棉花应蘸取的物质是(填代号)__________,其作用是______________
__________________________。
四、(本题包括2小题,共13分)
21.(6分)在100℃时,将0.100 mol的四氧化二氮气体充入1 L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) 浓度(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)(mol/L) | 0.100 | C1 | 0.050 | C3 | a | b |
| c(NO2)(mol/L) | 0.000 | 0.060 | C2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应的化学方程式为__________________________________;
达到平衡时四氧化二氮的转化率为_______________;
表中 C2_______C3_______a______b (选填“>”、“=”、“<”)
(2)20s时,四氧化二氮的浓度C1=____________mol/L,在0 s~20 s内四氧化二氮的平均反应速率为_____________mol/(L·s);
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是__________mol/L。
22.(7分)A、C、E、H是常见单质,B、F是常见氧化物,D是无色液体,I的焰色反应呈黄色。它们之间的转化关系如下图所示:

试回答:
(1) 写出化学式:B_______________ C________________;
(2) 写出反应①②的化学方程式:
①_______________________________________________________;
②_______________________________________________________;
(3)写出A与G溶液反应的离子方程式:
________________________________________________________。
五、(本题包括2小题,共12分)
![]() 23.(6分)聚氨酯是主链上含有
23.(6分)聚氨酯是主链上含有![]()
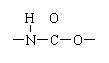
 重复结构单元的一种新型高分子化合物,在高档家具所用低发泡材料方向用途广泛。其单体是异氰酸酯(如
重复结构单元的一种新型高分子化合物,在高档家具所用低发泡材料方向用途广泛。其单体是异氰酸酯(如![]() O=C=N—R—N=C=O)和多元醇(如HO—R’—OH),高聚物结构简式为
O=C=N—R—N=C=O)和多元醇(如HO—R’—OH),高聚物结构简式为![]()
![]()
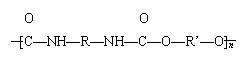
 。
。
![]() (1)由上述异氰酸酯和多元醇合成高聚物的反应类型为____________________。
(1)由上述异氰酸酯和多元醇合成高聚物的反应类型为____________________。
(2)苯聚氨酯类高聚物结构简式为
![]()

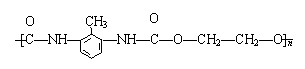
 ,
,
它由异氰酸酯A和多元醇B形成,则A和B的结构简式为:
A ____________________________;B___________________________。
24.(6分)“摇头丸”中含有氯胺酮成分。氯胺酮在一定条件下发生下列一系列转化:
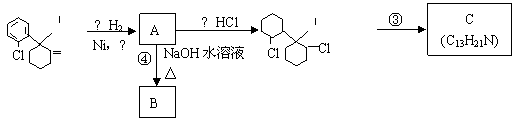 CH3
CH3
CH3
CH3
NH NH·HCl
O
(1)写出氯胺酮的分子式______________________;
(2)上述转化过程中发生取代反应的是____________;
反应③的条件是_____________________。
(3)C的结构简式可能为_________________、___________________。
六、(本题包括2小题,共14分)
25.(6分)超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:![]()
![]() 。由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
。由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
(1)取10.00 g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36 L(标准状况)。
①上述反应的化学方程式为_______________________________________;
②该样品中AlN的质量分数为_________________。
(2)另取10.00 g样品置于反应器中,通入2.016 L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34 g/L(已折算成标准状况,AlN不与O2反应)。该样品中含杂质炭_______g。
|
|
|
|
4CuO ==== 2Cu2O + O2 2SO3 === 2SO2 + O2
今取25.0 g CuSO4·5H2O晶体加热,使之均匀、缓慢升温至1000℃,并恒温1 h,请回答下列问题:
(1) 最终所得固体的颜色为_______,质量为_________g。
(2) 加热至某中间温度时,测量固体的质量,能否为10.0 g______(填“能”或“否”) 。
(3)不考虑实验带来的误差,在上述条件下反应,反应后的气态产物除去水后,物质的量可能为____________。(填写下列选项)
A.0 mol B.0.1 mol C.大于0.1 mol
(4)第(3)问中除上述三个选项外,你认为更准确的范围应该是什么?试通过计算予以说明。
参考答案
一、选择题(本题包括8小题,每小题2分,共16分)
1.B 2.C 3.D 4.A 5.B 6.B 7.C 8.C
二、选择题(本题包括10小题,每小题3分,共30分)
9.AD 10.B 11.C 12.CD 13.C 14.B 15.D 16.AB 17.BD 18.D
三、(本题包括2小题,共15分)
19.(6分)
(1)出现浑浊(1分);CO2+C6H5ONa+H2O→C6H5OH↓+NaHCO3 (1分)
(2)紫色褪去(1分);CaC2+2H2O→Ca(OH)2+C2H2↑(1分)
(3)出现白色胶状沉淀(1分):Al3++3NH3·H2O= Al(OH)3↓ + 3NH4+(1分)
20.(9分)
(1)②(1分);④(1分)
|
|
(3)⑥⑦(2分);红色褪去(1分)
(4)作安全瓶(或防止液态物质冲出)(1分)
(5)⑤(1分);吸收氮的氧化物(1分)
四、(本题包括2小题,共13分)
21.(6分)
(1)N2O4![]() 2NO2(1分);60%(1分);C2>C3 = a = b(1分)
2NO2(1分);60%(1分);C2>C3 = a = b(1分)
(2)0.070 (1分) ;0.0015(1分)
(3)0.200(1分)
22.(7分)
(1)Fe3O4(2分);Na(2分)
|
(2)①8Al+3Fe3O4==== 4Al2O3+9Fe (1分)
|
②3Fe+4H2O====Fe3O4+4H2 (1分)
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑(1分)
五、(本题包括2小题,共12分)
23.(6分)
(1)加聚(2分)
![]() CH3
CH3
(2)O=C=N— —N=C=O(2分);HO—CH2—CH2—OH(2分)
24.(6分)
(1)C13H16NOCl(1分)
(2)②、④(2分);强碱的醇溶液加热(1分)
![]()
![]()
![]() CH3
CH3
CH3
CH3
![]()
![]()
![]() NH
NH
NH
NH
![]()
![]() (3)
(1分);
(1分)
(3)
(1分);
(1分)
六、(本题包括2小题,共14分)
25.(6分)
(1)①AlN+NaOH+H2O=NaAlO2+NH3↑(1分)
②61.5%(2分)
(2)1.92 (3分)
26.(8分)
(1)红色(1分);7.20(2分)
(2)能(1分)
(3)C(1分)
(4)由CuO分解产生的n(O2)=0.025 mol
若SO3不分解,则n(SO3)=0.1mol (1分)
若SO3完全分解,则生成SO2和O2的物质的量为0.15 mol (1分)
故更准确的范围为大于0.125 mol,小于0.175 mol (1分)