高考化学模拟试卷十
可能且到的数据:原子量 H 1 C 12 N 14 O 16 Na 23 Al 27
S 32 Cl 35.5 Ca 40 Fe 56 Cu 64 Ag 108
一、选择题(本题包括5小题,每小题3分,共15分。每小题只有一个选项符合题意。)
1、你认为减少酸雨产生的途径可采取的措施是:①少用煤作燃料②把工厂烟囱造同③燃料脱硫④在已酸化的土壤中加石灰⑤开发新能源
A. ①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
2、将SO2通入BaCl2溶液至饱和未见沉淀,继续通入另一气体仍无沉淀,通入的气体可能是
A.CO2 B.NH3 C.NO2 D.H2S
3、下列过程中,共价键被破坏的是
A.碘升化 B.溴蒸气被木炭吸附
C.酒精溶于水 D.HCl气体溶于水
4、某学生做完实验以后,采用下列方法分别清洗所用仪器
(1)用稀哨酸清洗做过银镜反应的试管;
(2)用酒精清洗做过碘升华的烧杯;
(3)用浓盐酸清洗做过高锰酸钾分解实验的试管;
(4)用盐酸清洗长期存放过三氯化铁溶液的试剂瓶;
(5)用氢氧化钠溶液清洗盛过苯酚的试管。
你认为他的操作:
A.(2) 不对 B.(3),(4)不对 C.(4),(5)不对 D.全部正确
5、青苹果汁最碘溶液显蓝色,熟苹果能还原银氨溶液,这说明
A.青苹果中只含淀粉不含糖类 B.熟苹果中只含糖类不含淀粉
C.苹果转熟时淀粉水解为单糖 D.苹果转熟时单糖聚合成淀粉
二、选择题(本题包括12小题,每小题3分,共36分。每小题有一个或两个选项符合题意,若正确答案只包括一个选基,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
6、短周期元素A、B、C原子序数集次递增,它们原子量的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数。下列叙述正确的是
A.原子半径A<B<C
B.A的氢化物的稳定性大于C的氢化物
C.B的氢化物的熔点比A氧化物高
D.A与C可形成离子化合物
7、废切削液中,含2%~5%NaNo2, 直接排放会造成环境污染,下述试剂中能使其转化为不引起二次污染的N2的是
A.H2O2 B.NH4Cl C.NaCl D.浓H2SO4
8、反应![]() 在5L的密闭器内进行半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率
在5L的密闭器内进行半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率![]() 为
为
A.![]() B.
B.![]()
C.![]() D.
D. ![]()
9、下列分子中的14个碳原子不可能处在同一平面上的是
A.![]() B.
B.![]()
C.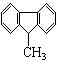 D.
D.![]()
10、在实验室中,能用固一固加热制气装置,又能用固一液常温制气装置制取的气体可能是下列中的
A.O2 B.H2 C.CH4 D.CO2
11、设NA表示阿伏加德罗常数,下列说法不正确的是
A.标准状况下,22.4L辛烷全燃烧后,行成气态产物的分子数为8NA
B.31g白磷中含有1.5NA个P—P键
C.在1.01×105 Pa和120℃时,18g水中含有的电子数为10NA
D.500mL 0.5 mol ·L-1的Ca(NO3)2溶液中,Ca2+的物质的量浓度为
0.5 mol·L-1
12、用物质的量都是0.1mol的CH3COOH与CH3COONa配制成1L溶液,已知其中
[CH3COO-]>[Na+],有关该混合液的下列判断正确的是
A.[H+]>[OH-]
B.[CH3COOH]>[CH3COO-]
C.[CH3COO-]+[CH3COOH]=0.2 mol·L-1
D.[CH3COO-]+[OH-]=0.1 mol ·L-1
13、下列各组离子在指定环境下能大量共存的是
A.pH=1的溶液中![]()
B.pH=7的溶液中![]()
C.pH>1的溶液中![]()
D.pH=0的溶液中![]()
14、据报道,美国正在研究的锌电池可能取代目前广泛使用的铅蓄电池,它具有容量大等优点,其电池反就为2Zn+O2=2ZnO,其原料为锌、电解液和空气,则下列叙述正确的是
A.锌为正极,空气进入负极反应 B.负极反应为Zn-2e ==== Zn2n+ C.正极发生氧化反应 D.电解液肯定不是强酸
15、已知:为使Fe3+、Fe2+、Zn2+ 较完全地形成氢氧化物沉淀,溶液的pH值分别为3.7, 9.6, 4.4左右,某硫酸锌酸性溶液中含有少Fe2+、Fe3+杂志离子,为除去这些离子,为除去这些离子制得纯净的硫酸锌,应加入的试剂是
A.NaOH溶液 B.氨水
C.KMnO4、ZnCO3 D.H2O2、ZnO
16、下列离子方程式正确的是
A.在氢氧化钡溶液中加入过量小苏 打:
![]() ====
====![]()
B.在氢氧化钾的稀溶液中通过量的二氧化硫气体:
![]() ====
====![]()
C.氯化铁水解:
![]() ====
====![]()
D.氯气通入水中:
![]() ====
====![]()
17、将AlCl3溶液和NaAlO2溶液分别蒸发并灼热。所怎么得产物的主要成分是
A.均为Al(OH)3 B.前者得Al2O3, 后者是NaAlO2
C.均为Al2O3 D.前者得AlCl3, 后者是NaAlO2
三、选择题(本题包括8小题,每小题4分,共32分,每小题只有一个选项符合题意)
18、在25℃时,pH值等于11的NaOH溶液和NaCH溶液,两溶液中水的电离度大小的比较正确的是
A.相等 B.后者比前者大11倍
C.后者是前者108 D.前者是后者108倍
19、不用其它仪器和试剂,仅用试管和胶头滴管无法鉴别的两种溶液是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
20、在密闭容器中,对于反应:N2+3H2![]() 2NH3,在反应起始时N2和H2分别为10 mol 和30 mol, 当达到平衡时,N2的转化率为30%,若以NH3为起始反应物,反应条件与上述反应相同时,欲使其达到平衡时各成分的体积分数与前者相同,则NH3的起始物质的量和它的转化率,正确的是( )
2NH3,在反应起始时N2和H2分别为10 mol 和30 mol, 当达到平衡时,N2的转化率为30%,若以NH3为起始反应物,反应条件与上述反应相同时,欲使其达到平衡时各成分的体积分数与前者相同,则NH3的起始物质的量和它的转化率,正确的是( )
A.20 mol, 70% B.20 mol, 30%
C.40 mol, 35% D.10 mol, 50%
21、某碱式碳酸镁[Mg(OH)2·XMgCO3]固体31 g 恰好跟100mL 8mol·L-1的盐酸反应生成MgCl2的溶液,则X为:
A.1 B.2 C.3 D.4
22、将浓度为a%的NaOH溶液蒸发掉m g水后,变成2 a%的NaOH不饱和溶液V mL,所得溶液的物质的浓度
A.![]() B.
B.![]()
C.![]() D.
D.![]()
23、14g铜、银合金跟足量的浓哨酸反应,将产生的NO2气体与1.12L(标准状况)氧气混合,通入水中恰好全部吸收,则合金中铜的质量是
A.1.6g B.3.2g C.6.4g D.9.6g
24、工业上将苯的苯的蒸气通过赤热的铁合成一种可作传热载体的化合物,该化合物分子中苯环上的一氯代物有3种,1mol该化合物催化加氢时最多消耗6 mol氢气,判断这种化合物可能是
A.![]() B.
B.![]()
C.![]() D.
D.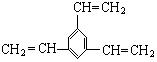
![]()
25、含n g HNO3的稀溶液恰好与m g铁粉完全反应,若HNO3 只被还原为NO,则n∶m可能是①5∶1②9∶2③3∶1④2∶1⑤4∶1
A. ②③⑤ B. ①③④ C .②③ D. ①③⑤
四、(本题包括2小题,共17分)
26、(6分)有A、B两种有机液体的混合物,如果A、B互溶,且相互不发生化学反应,在常压下,A沸点为35℃,B的沸点为200℃。用蒸馏方法分离和提纯该混合物,必不可少的玻璃仪器是:
。
27、(11分)烟道气主要含有(1)CO2 (2)CO (3)O2 (4)N2(其它气体不计),为测定各组气体的含量,且能除去有害气体,有容积均为250mL的如下装置(相同的条件下测定各种气体,吸收剂足量,水蒸气忽略不计):
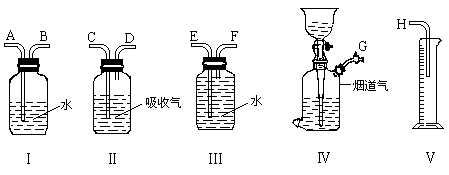
用1,2,3—三羟基苯(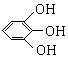 )的碱溶液吸收O2
)的碱溶液吸收O2
![]()
用Cu2Cl2的氨水溶液(加少量铜丝防止Cu2Cl2被氧化)吸收CO
![]()
用KOH吸收CO2
(1)说明先吸收CO2,后吸收O2的理由: 。
(2)按气流方向测定并吸收第一种气体时,装置的连接从左至右的顺序是 。
(填写A、B……字母)。装置Ⅲ的作用是 。
(3)实验中O2和CO的吸收顺序能否颠倒,为什么 。
(4)在测定和吸收CO2,CO,O2气体后,剩余气体除N2外还可能含有 , 应用 吸收后,再测定N2的体积。
五、(本题包括3小题,共16分)
28、(4分)1986年,化学上第一次用非电解法制得氟气,试配平该反应的化学方程式:
![]()
反应中被氧化的元素是 。若消耗0.1 mol氧化剂,则被氧化的还原剂为 mol.
29、(6分)已知X和Y均为短周期元素,单质X在空气中点燃,能发出耀眼的白光,在一定条件下,单质X和单质Y反应 ,生成化合物Z,Z与水作用可生成气体G和白色沉淀P(如下框图所示),已知气体G与氢气之密度比约为8.5。
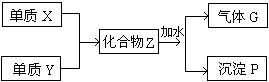
(1)组成单质X和Y的元素分别属第 族和第 族。
(2)化合物Z的化学式为 。
(3)每生成1 mol的气体G,同时应得到 mol 的沉淀P。
30、(6分)已知:![]() 。今有一白色固体,可能是由
。今有一白色固体,可能是由![]() 中的2种或3种组成,为确定该白色固体组成,进行以下实验:取白色固体少许,加入适量蒸馏水充分振荡,得到无色溶液;取无色溶液少许,滴加稀硝酸,有白色沉淀生成。
中的2种或3种组成,为确定该白色固体组成,进行以下实验:取白色固体少许,加入适量蒸馏水充分振荡,得到无色溶液;取无色溶液少许,滴加稀硝酸,有白色沉淀生成。
(1)此白色固体必须含有的物体是①第一组 ;②第二组 。
(2)若要确定白色固体的组成,还需做的实验是 。
六、(本题包括3小题,共18分)
|
|
31、(4分)有机物A的碳架结构如图所示,已知立方烷(C8H8)与![]() 互为同分异构体,请写出有机所A互为同分异构体、且属于醛类的结构简式:
互为同分异构体,请写出有机所A互为同分异构体、且属于醛类的结构简式:
(1) 、(2) 、(3) 、(4) 。
32、(6分)已知可发生如下化学反应:①R-X+H2ORO ![]() ROH+HX
ROH+HX
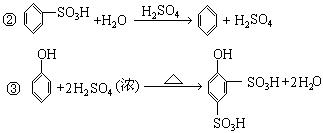
请用化学方程式表示苯、水、溴、浓硫酸、烧碱为原料合成![]() 料的过程。
料的过程。
(1)
(2)
(3)
(4)
(5)
33、(8分)下面是一个四肽,它可以看作是4个氨基酸缩合掉3个分子水而得。
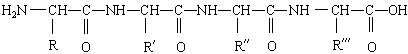
式中,![]() 可能相同的或不同的烃基,或有取代基的烃基。
可能相同的或不同的烃基,或有取代基的烃基。![]() 称为肽健,今有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种
称为肽健,今有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种
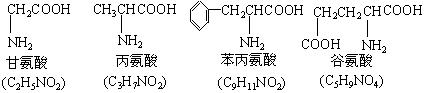
(1)该多肽是 肽(填汉字)
(2)该多肽水解后,得到 个谷氨酸分子、 个丙氨酸分子(填数字),其理由是(简要文字叙述或列出议程组均可):
七、(本题包括2小题,共16分)
34、(6分)测血钙的含量时,可将 2ml血液用蒸馏水稀释后,向其中加入足量草酸铵晶体(化学式为(NH4)2C2O4),反应生成CaC2O4沉淀,将沉淀用稀硫酸处理 得H2C2O4后再用KMnO4溶液滴定(氧化物为CO2,还原产物为Mn2+),结果用去1.0×
10-4mol·L-1的KMnO4溶液20.0mL, 由此可知100mL该血液中的含钙量是多少g?(KMnO4和 H2C2O4的反应式为:
![]() )
)
35、(10分)氢氧化钙在20℃时,每100g水仅溶解0.17g。
(1)求在20℃将100g水中加入7.4g Ca(OH)2固体,求溶液中OH-的物质的量浓度(密度为1g·cm-3)
(2)在上述的混合物中需加入几mL 0.10mol·L-1的K2CO3溶液,才能使Ca2+的浓度降至0.010 mol L-1?
(3)已知20℃时CaCO3在水中达到溶解平衡(![]() )时,其离子浓度之积为一常数,即[Ca2+][CO
)时,其离子浓度之积为一常数,即[Ca2+][CO![]() ]=8.0×10-9.在[Ca2+]
]=8.0×10-9.在[Ca2+]![]() 1.0×10-5mol·L-1时可视为Ca2+沉淀完全,在前述(1)中溶液中要使Ca2+沉淀完全,求应加入0.10molL-1K2CO3溶液的最小体积。
1.0×10-5mol·L-1时可视为Ca2+沉淀完全,在前述(1)中溶液中要使Ca2+沉淀完全,求应加入0.10molL-1K2CO3溶液的最小体积。