高考化学模拟试卷十二
可能用到的数据:相对原子质量H 1 C 12 N 14 O 16 Na 23 Al 27
S 32 Cl 35.5 Ca 40 Fe 56 Cu 64 Ag 108
一、选择题(本题包括5小题,每小题3分,共15分,每小题只有一个选项符合题意)
1.1995年美国教授Lagow报道,他制得了碳的第四种同素异形体--链式炔碳:…
![]() 该物质一个分子中含300-500个碳原子,性质很活泼,据此判断链式炔碳的熔点,估计比石墨
该物质一个分子中含300-500个碳原子,性质很活泼,据此判断链式炔碳的熔点,估计比石墨
(A)高 (B)低 (C)相等 (D)无法判断
2.被称为“未来钢铁”的钛元素(Ti)有多种同位素,如![]() 这些同
这些同
位素原子中的中子数不可能为
(A)30 (B)28 (C)26 (D)24
3.能够用键能的大小作为主要依据来解释的是
(A)常温常压下氯单质呈气态而溴单质呈液态
(B)硝酸是挥发性酸而硫酸、磷酸是不挥发性酸
(C)稀有气体一般难于发生化学反应
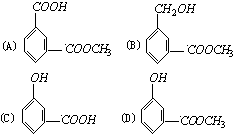
(D)空气中氮气的化学性质比氧气稳定
4.下列实验操作中,仪器需插入液面下的有
①制备Fe(OH)2,用胶头滴管将NaOH溶液滴入FeSO4溶液中;②制备氢气,简易装置中长颈漏斗的下端管口;③分馏石油时测量温度所用的温度计;④用乙醇制备乙烯时所用的温度计;⑤用水吸收氨气时的导气管;⑥向试管中的BaCl2溶液中滴加稀硫酸.
(A)③⑤⑥ (B)②⑤ (C)①②④ (D)①②③④⑤⑥
5.下列各组物质中,两者互为同分异构体的是
①CuSO4·3H2O和CuSO4·5H2O ②NH4CNO与CO(NH2)2 ③C2H5NO2和NH2CH2COOH
④[Pu(H2O)4]Cl3与[Pu(H2O)2Cl2]·2H2O·Cl
(A)①②③ (B)②③④ (C)②③ (D)③④
二、选择题(本题包括12小题,每小题3分,共36分,每小题有一个或两个选项符合题意)若正确答案只包括一个选项,多选时,该小题为0分,若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分)
6.下面说法正确的是(N表示阿伏加德罗常数)
(A)在标准状况下,VL水含有的氧原子个数是![]()
(B)常温常压下,1mol羟基(-OH)所含电子数为9N
(C)在反应![]() 中生成1molCO,电子转移数为3N.
中生成1molCO,电子转移数为3N.
(D)2
L 1mol·L-1的盐酸中,所含氢离子总数约为2N
7.在一定条件下,氯气与碘单质以等物质的量进行反应,可得到一种红棕色液体ICl,ICl,
有很强的氧化性,ICl跟Zn、H2O反应的化学方程式如下
2ICl+2Zn=ZnCl2+Znl2
ICl+H2O=HCl+HIO
下列关于ICl性质的叙述正确的是
(A)ZnCl2是氧化产物,又是还原产物
(B)ZnI2是氧化产物,又是还原产物
(C)ICl跟H2O的反应,ICl是氧化剂,H2O是还原剂
(D)ICl跟H2O的反应,是自身氧化还原反应
8.下列离子方程式书写正确的是
(A)碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液
![]()
(B)碳酸钠溶液中加入等物质的量的乙酸
![]()
(C)Ca(ClO)2溶液中通入过量的二氧化硫气体
![]()
(D)用炭棒作电极电解氯化钠饱和溶液
![]()
9.体积相同的甲、乙两个容器中,分别都充有等物质的量的NH3,在相同温度下,发生反应
:![]() ,并达到平衡.在这个过程中,甲容器保持体积不变,乙容器保持
,并达到平衡.在这个过程中,甲容器保持体积不变,乙容器保持
压强不变,若甲容器中NH3的转化就率为P%,则乙容器中NH3的转化率为
(A)等于P% (B)小于P% (C)大于P% (D)无法判断
10.铅蓄电池效率低、污染大,现在研究用锌电池取代它.其电池反应为2Zn+O2=2ZnO,其原料为锌、空气和电解质溶液,则下列叙述正确的是
(A)锌为正极,空气进入负极反应
(B)正极发生氧化,负极发生还原反应
(C)负极电极反应是:Zn-2e+2OH-=ZnO+H2O
(D)电池工作时溶液pH保持不变
11.用15mL 2mol·L-1的H2SO4溶液与15mL 3 mol·L-1的Na2CO3溶液反应来制取二氧化碳,欲制得最多的二氧化碳,则下列叙述正确的是
(A)把两种溶液快速混合并不断搅拌
(B)把两种溶液缓慢混合并不断搅拌
(C)把Na2CO3溶液滴加到H2SO4溶液中
(D)把H2SO4溶液滴加到Na2CO3溶液中
12.下列溶液中通入足量SO2后,最终一定会出现的沉淀的是
(A)Na2S (B)BaCl2 (C)Ba(NO3)2 (D)Ca(OH)2
13.常温用水稀释0.1mol·L-1的醋酸钠溶液,溶液中增大的是
![]()
14.用物质的量均是0.1mol的CH3COOH和CH3COONa配成1L溶液,[Na+]<[CH3COO-]下列判断正确的是
(A)[OH-]<[H+] (B)[CH3COOH]+[CH3COO-]=0.2mol·L-1
(C)[CH3COOH]>[CH3COO-]
(D)[CH3COO-]+[OH-]=0.1mol·L-1
15.若向无色透明的溶液中加入铝粉,反应后生成氢气,则原溶液肯定不存在的离子组是
![]()
16.把一定量的有机物溶于NaOH溶液中,滴入酚酞试液呈红色,煮沸5分钟后,溶液颜色变浅,再加入盐酸,显酸性析出白色晶体,取少量晶体放到FeCl3溶液中,溶液呈紫色,则有机物可能是下列物质中的
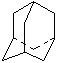
17.金刚烷的结构如图,它可看作是由四个等同的六元环组成的空间构型.请根据中学学过的异构现象判断由氯原子取代金刚烷亚甲基(-CH2-)中的氢原子所形成的二氯代物的种类
(A)4种 (B)3种 (C)2种 (D)5种
三、选择题(本题包括8小题,每小题4分,共32分,每小题只有一个选项符合题意)
18.制备卤磷酸钙萤光粉所用的高纯氯化钙中混有镁离子,除去的方法是把氯化钙的水溶液加热到90~95℃,在不断搅拌下加入适当的沉淀剂,使镁离子生成沉淀过滤除去.此沉淀剂最好选用
(A)氢氧化钙乳浆 (B)碳酸钠溶液 (C)碳酸氢钠溶液 (D)氢氧化钠溶液
19.用一定浓度的NaOH标准溶液分别中和相同体积和相同pH的两种酸溶液:A1(一元弱酸,电离度1.0%)、A2(一元强酸),则所需NaOH溶液体积比(A1:A2)
(A)1:1 (B)1:10 (C)100:1 (D)1:100
20.t℃时,Na2CO3的溶解度为Ag,现在饱和碳酸钠的溶液(100+A)g,溶质质量分数a%,向溶液中投入Na2CO3固体Ag,静置后析出少量结晶(Na2CO3·10H2O),加水使结晶全部溶解,所得溶液仍为a%,加入的水量是
(A)100g (B)(100+A)g (C)![]() (D)(100-A·a%)g
(D)(100-A·a%)g
21.1LNa2SO4和CuSO4的混合溶液中,![]() 为2mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中c(Na+)为
为2mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中c(Na+)为
(A)0.5mol·L-1 (B)1.5 mol·L-1 (C)1 mol·L-1 (D)2 mol·L-1
22.两种短期元素组成的化合物中,原子个数比为1:3,若两种元素原子序数分别为a和b,则a和b的关系可能是
①a=b+5
②a+b=30 ③a+b=8 ④a=b+8
(A)②③ (B)②③④ (C)①②③④ (D)③④
23.工业废气中氮的氧化物是重要的污染源,有一种治理污染的方法是通入适量氨气将其还原为无毒物质N2和H2O,现有含氮氧化物NO和NO2的混合气体3L,用同条件下的NH33.5L恰好反应完全,则混合气中NO与NO2的体积分数比量
(A)1:4 (B)1:3 (C)1:2 (D)1:1
24.一定温度下,ωg下列物质在足量氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重ωg,符合此要求的是
①H2
②CO ③CO和H2
④HCOOCH3 ⑤HOOC-COOH
(A)全部 (B)仅④⑤ (C)仅①②③ (D)除⑤以外
25.一定条件下,可逆反应A(气)+3B(气)![]() 2C(气)达平衡时,测得A、B的转化率分别为25%和37.5%,则反应开始时充入容器中A和B的物质的量之比是
2C(气)达平衡时,测得A、B的转化率分别为25%和37.5%,则反应开始时充入容器中A和B的物质的量之比是
(A)1:3 (B)1:2 (C)3:1 (D)2:3
四、(本题包括2小题,共18分)
26.(6分)某光卤石(KCl·MgCl2·6H2O)样品中含有不跟NaOH溶液、盐酸反应的杂质.为测定样品中KCl·MgCl2·6H2O的质量分数.有如下操作:
A.称取ag样品,放入锥形瓶中加适量水溶解.
B.往锥形瓶中加入bmol·L-1的NaOH溶液100mL(过量),振荡.
C.过滤并冲洗沉淀2-3次,收集滤液及洗液于锥形瓶中.
D.往沉淀中滴加cmol·L-1的稀HCl溶液至沉淀溶解,消耗盐酸V1mL.
E.用cmol·L-1的盐酸滴定过量的NaOH至终点,消耗盐酸V2mL.
F.向步骤B锥形瓶中加入指示剂2-3滴.
G.向步骤C锥形瓶中加入指示剂2-3滴.
回答:
(1)正确且必要的操作顺序是________________.(填序号)
(2)KCl·MgCl2·6H2O质量分数是___________________________________.
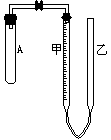
27.(12)现有实验药品:一定质量的锌(分片状和粒状两种)、浓H2SO4(密度1.84·cm-1)、水以及右图装置,图中量气管B是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度(0-100mL),甲、乙管可固定在铁架上,供量气用,乙管可上下移动,以调节液面高低,利用此装置可测定锌的相对原子质量.(设锌全部反应,产生的气体不超过50mL).回答下列问题:
(1)实验前为检查装置的气密性,先将A、甲、乙三管固定,乙管中注入水,液面高于甲液面,静置片刻,____________,说明装置气密性良好.
(2)按图示装置实验,要保证不漏出H2,应如何操作?_________________________________________________________
(3)为了准确地测量H2的体积,在读取反应后甲管中液面的读数时,应注意__________(填写序号).
(A)视线与凹液面最低处相平
(B)等待片刻,待乙管液面不再上升时读数
(C)读数时应上、下移动乙管,使甲、乙两管液面相平
(D)读数时不一定使甲、乙两管液面相平
(4)设计一个不用量气管,而用中学常用仪器测量H2体积的装置,应选用的仪器(自选)是 ________________________________________________,
五、(本小题共2小题,共14分)
28.(6分)NO分子因污染空气而臭名昭著.近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点,NO亦被称为"明星分子".请回答下列问题.
(1)NO对环境的危害在于________(填下项目的编号)
(A)破坏臭氧层
(B)高温下能使一些金属被氧化
(C)造成酸雨
(D)与人体血红蛋白结合
(2)在含Cu+离子的酶的活化中心中,亚硝酸根离子![]() 可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式:_________________________.
可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式:_________________________.
(3)在常温下,把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式___________________________________.
(4)解释变化(3)中为什么最后气体总压力小于原压力的![]() _________________.
_________________.
29.(8分)
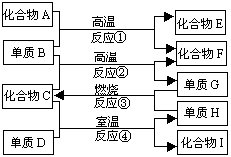
如上图,已知:
①化合物E与水反应生成白色浆状物;②化合物F是不能生成盐的氧化物③单质D能与某些稀有气体反应;据此,请填空;
(1)化合物F是________.
(2)化合物I是_________.
(3)反应②的化学方程式是_______________________________.
(4)反应④的化学方程式是_______________________________.
六、(本题包括2小题,共20分)
30.(6分)有如下反应![]() 军事上的“地表伪装”是军事上
军事上的“地表伪装”是军事上
保护的外观色彩、红外反射与环境吻合.BASF是菲系新型红外伪装还原染料,为橄榄色或黑色.其化学结构为:
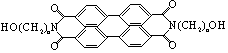
(1)料BASF的分子式_____________;
(2)1mol该物质与Na反应,产生氢气量以及在催化剂作用下加成所需氢气物质的量,最大值分别为_________,__________;
(3)当n=3时,其一氯取代物可能有__________种;
(4)和N原子直接相连的C原子________(填能或不能)处于同一平面.
31.(14分)
已知: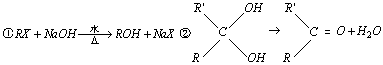 烃A能
烃A能
发生下面一系列化学反应:

(1) 请写出下列物质的结构简式:
A___________,C___________,E___________,G___________.
(2)写出化学方程式:
②________________________________,⑤________________________________.
(3)属于加成反应的有________________,E--G的反应类型是___________.
七、(本题包括2小题共15分)
32.(7分)环保检测中,有害气体的浓度常用1L有害气体的毫克值(mg·L-1)来表示,如对某气体样品中所含一氧化碳的浓度进行测定,其方法和实验步骤如下:
①首先将2.00L的气体样品通过盛有I2O5固体的加热管,反应后生成CO2和I2;
②用30.0mL
5.00×10-3mol·L-1的硫代硫酸钠溶液吸收所产生的碘,发生的反应为:
③将②中溶液取出1/5,加入1.00mL 1.00×10-2mol·L-1碘水,正好将所取溶液中过量的硫代硫酸钠完全氧化.
(1)写出步骤①中CO通过盛I2O5加热管的有关反应化学方程式.
(2)计算样品中CO的浓度.
33.(8分)向100mL某二价金属M的氢氧化物澄清溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的盐酸溶液中,在标准状况下收集到4.48L气体.将滤液加水稀释至250mL,取出25mL恰好与20mL盐酸完全反应,在标准状况下收集到1.12L气体.
(1) M的氢氧化物澄清溶液与NaHCO3溶液反应的化学方程式为:
______________________________________________________.
(2)要计算金属M的原子量,你认为还必须提供下列哪项数据(填写供选项字母序号)
_________________.
(A)M的氢氧化物溶液的物质的量的浓度(设为2mol·L-1)
(B)M的碳酸盐的质量(设为39.4g)
(C)与M的碳酸盐反应的盐酸的物质的量浓度(设为0.1mol·L-1)
(D)题设条件充足,不需要补充数据.
(3)根据你的选择,试计算金属M的原子量和加入的NaHCO3溶液中所含的NaHCO3的质量
参考答案
一、二、三选择题
1.B 2.A 3.D 4.C
5.B 6. BD 7.B 8 D 9.C 10.CD 11.C 12.AC 13.AD 14.AB 15.AD 16.D 17.B
18.A 19.C 20.A 21.D 22.C 23.B 24.D 25 B
四、(共18分)
26.(6分)A、B、C、G、E(4分)选项完全且顺序正确得4分。每多选一项扣1分,不出现负分。
![]() (2分)
(2分)
27.(12分)(1)液面保持不动(2分)
(2)将A试管胶塞打开,![]() ,液体体积不超过
,液体体积不超过![]() 试管容积的 ,振荡;
试管容积的 ,振荡;![]() 锌
锌
与稀硫酸接触。(5分)
a、b、c、d、e五项操作顺序正确,每项各得1分,共计5分。若其中某项操作漏选或错选,该操作后所做答案均不得分。
(3)A、C(2分)多选、错选每个扣1分,不出现负分。
(4)广口瓶、带导管双孔胶塞、量筒。(3分)少选、多选、错选每个扣1分,不出现负分。
五、(14分)
28.(6分)(1)A、C、D(3分)每个选项1分,多选、错选扣1分不出现负分。
![]() (1分)
(1分)
![]()
(4)存在化学平衡:2NO2![]() N2O4(1分)
N2O4(1分)
29.(8分)(1)CO(2分) (2)HF(2分)
![]()
(4)2F2+2H2O=4HF+O2
(2分)
六、(共20分)
30.(6分)![]() (2分) (2)1mol,14mol(每空1分) (3)5(1分) (4)能 (1分)
(2分) (2)1mol,14mol(每空1分) (3)5(1分) (4)能 (1分)
31.(14分)
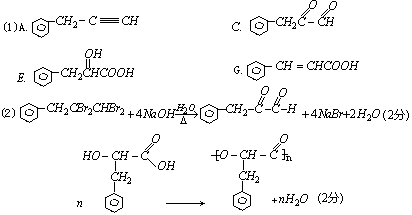
(3)①、④、⑦(1分)多选,错选扣1分,不出现负分,消去反应(1分)
七、(共15分)
32.(7分)![]() (2分)
(2分)
(2)解:1.00×10-3L×1.00×10-2mol·L-1=1.00×10-5mol
设:1.00×10-5mol I2消耗Na2S2O3物质的量为x
关系式:2Na2S2O3~I2. x=2.00×10-5mol…………………………(1分)
2 mol1 mol
x 1.00×10-5mol
CO还原出的I2消耗Na2SO3的物质的量:
30.0×10-3L×5×10-3mol·L-1-2.00×10-5mol×5=5.00×10-5mol…………(1分)
设:CO的物质的量为y0
关系式: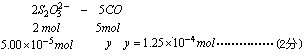
CO的浓度![]() (1分)
(1分)
33.(8分)(1)M(OH)2+2NaHCO3=MCO3↓+2H2O+Na2CO3………………(1分)
(2)B (3分)多选不得分
(3)解: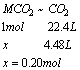
MCO3的摩尔质量![]()
M的原子量=197-60=137………………(2分)
共产生CO2的物质的量![]()
![]() (2分)
(2分)