《电离平衡》、《化学平衡》测试题
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Si-28 P-31 S-32 Cl-35.5 K-39 Ca-40 Fe-56 Cu-64
第Ⅰ卷(满分60分)
一、选择题(每小题只有一个选项符合题意,共30![]() 2=60分。)
2=60分。)
1.
反应4NH3+5O2 ![]() 4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是
4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是
A.V(O2)=0.01mol·L-1 ·s-1 B.V(NO)=0.008mol L-1 ·s-1
C.V(H2O)=0.015mol L-1 ·s-1 D.V(NH3)=0.002mol L-1 ·s-1
2. 一定温度下,在固定容积的密闭容器中,可逆反应:
mA(气)+nB(气) ![]() pC(气)+qD(气),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率VA:VB:VC:VD=m:n:p:q,其中,能说明反应已达到平衡的是
pC(气)+qD(气),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率VA:VB:VC:VD=m:n:p:q,其中,能说明反应已达到平衡的是
A.只有③④ B.②③④ C.①⑵⑶④ D.①②③④⑤
3.
在3NO2+H2O![]() 2HNO3+NO+Q反应达到平衡后,改变下列条件,可使HNO3浓度增大的是
2HNO3+NO+Q反应达到平衡后,改变下列条件,可使HNO3浓度增大的是
A.升温 B.减压 C.加水 D.通入O2
4. 从下列事实,不能用勒沙特列原理解释的是
A.溴水中有下列平衡Br2+H2O![]() HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g)![]() H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深
C.反应CO+NO2![]() CO2+NO+Q,升高温度可使平衡向逆反应方向移动
CO2+NO+Q,升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
5.
将2 mol SO2和2 mol SO3气体,充入固定体积的密闭容器,在一定条件下发生下列反应:2SO2+O2
![]() 2SO3,平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时SO3的物质的量大于n mol的是
2SO3,平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时SO3的物质的量大于n mol的是
A.2 mol SO2+1mol O2 B.4 mol SO2+1mol O2
C.2 mol SO2+1mol O2 +2 mol SO3 D.3 mol SO2+1 mol SO3
6.
一定温度时于密封容器中发生反应:mA(g)+nB(g) ![]() pC(g),达平衡后,若将气体体积压缩到原来的1/2。当再达平衡时C的浓度是原来的1.9倍,则下列叙述正确的
pC(g),达平衡后,若将气体体积压缩到原来的1/2。当再达平衡时C的浓度是原来的1.9倍,则下列叙述正确的
A.平衡向正反应方向移动 B.C气体的质量分数增大
C.气体A的转化率降低 D.m+n>p
7.
在某一密闭容器中,充入一定量的HI气体,发生反应2HI(气) ![]() H2(气)+I2(气)-Q,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
H2(气)+I2(气)-Q,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
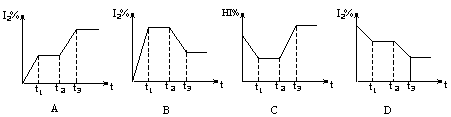 |
8. 翰林汇下列可逆反应达平衡状态后,降温可以使混和气体平均分子量减小的是
A.H2(气)+Br2(气)![]() 2HBr(气)+Q
2HBr(气)+Q
B.N2(气)+3H2(气)![]() 2NH3(气)+Q
2NH3(气)+Q
C.2SO3(气)![]() 2SO2(气)+O2(气)-Q
2SO2(气)+O2(气)-Q
 D.4NH3(气)+5O2(气)
D.4NH3(气)+5O2(气)![]() 4NO(气)+6H2O(气)+Q翰林汇
4NO(气)+6H2O(气)+Q翰林汇
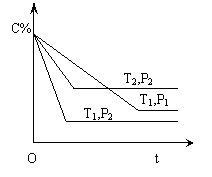
9.
![]() 已知某可逆反应:mA(气)+nB(气)
xC(气) +Q ,在密闭容器中进行,右图表示反应在不同时间t ,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则
已知某可逆反应:mA(气)+nB(气)
xC(气) +Q ,在密闭容器中进行,右图表示反应在不同时间t ,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则
A.T1>T2 ,P1>P2 ,m+n>x ,Q>0
B.T1<T2 ,P1<P2 ,m+n<x ,Q<0
C.T1>T2 ,P1<P2 ,m+n<x ,Q>0
D.T1<T2 ,P1>P2 ,m+n>x ,Q<0
10.
翰林汇将固体NH4I置于密闭容器中,在某温度下发生反应:NH4I(固)![]() NH3(气)+HI(气);2HI(气)
NH3(气)+HI(气);2HI(气)![]() H2(气)+I2(气)。当反应达到平衡时,[H2]=0.5摩/升,[HI]=4摩/升,则氨的浓度为
H2(气)+I2(气)。当反应达到平衡时,[H2]=0.5摩/升,[HI]=4摩/升,则氨的浓度为
A.3.5% B.4 mol·L-1 C.4.5 mol·L-1 D.5 mol·L-1
11. 常温常压下在带有可移动活塞的甲、乙容器(如图)里分别充有二氧化氮和空气,现分别进行下列两个实验:①将两容器置于沸水中加热 ②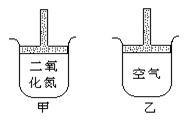 在活塞上都加2千克的砝码
在活塞上都加2千克的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
A.①甲>乙 ②甲>乙 B.①甲>乙 ②甲<乙
C.①甲<乙 ②甲>乙 D.①甲>乙 ②甲=乙翰林汇
12. NH3加热分解为N2和H2,在相同条件下,测得分解后混合气体密度为分解前的2/3,则氨的分解率为
A.50% B.60%
C.40%
D.80%
13.能证明醋酸是弱酸的事实是
A.醋酸能使紫色石蕊试液变红 B.醋酸能被弱碱氨水中和
C.醋酸钠溶液的pH不等于7
D.常温下,0.1 mol·L-1醋酸溶液中的c(H+)为1.32×10-3mol·L-1
14.在水中加入下列物质,可使水的电离平衡正向移动的是
A.NaCl B.Na2CO3 C.NH3·H2O D.H2SO4
15.常温下,在0.1 mol·L-1 CH3COOH溶液中,水的离子积是
A. 1×10-14 B. 1×10-13 C. 1.32×10-14 D. 1.32×10-15
16.能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是
A.向水中投入一小块金属钠 B.将水加热煮沸
C.向水中加入硝酸铵晶体 D.向水中加食盐晶体
17.体积相同的下列液体中,所含H+的个数最少的是
A.蒸馏水 B. 0.1mol·L-1 H2SO4
C. 0.1 mol·L-1 NaOH D. 0.1mol·L-1 Ba(OH)2
18.体积相同,pH也相同的HCl、HNO3、CH3COOH分别与足量的NaHCO3反应,产生CO2的体积
A.同样多 B. HCl最多 C. HNO3一样多 D. CH3COOH最多
19.下列试纸中,在测溶液的性质时,预先不能用蒸馏水润湿的是
A.石蕊试纸 B.醋酸铅试纸
C.KI淀粉试纸 D.pH试纸
 |
20. 下列物质的分类组合全部正确的是
21. 下列说法正确的是
A.水解反应是吸热反应 B.升高温度可以抑制盐类的水解
C.正盐水溶液pH均为7 D.硫酸钠水溶液pH小于7
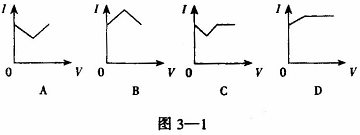
22.醋酸溶液中滴入稀氨水,溶液的导电能力发生变化,其电流强度I随加入氨水的体积V的变化曲线图如下图的是
23.化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
![]() HIn(溶液) H+(溶液)+ In-(溶液)
HIn(溶液) H+(溶液)+ In-(溶液)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液: ①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液
⑤NaHCO3溶液 ⑥氨水,其中能使指示剂显红色的是
A.①④⑤ B.②⑤⑥ C.①④ D.②③⑥
24.下列物质的水溶液,由于水解而呈酸性的是
A. NaHSO4 B. NaHCO3 C. HCl D. AlCl3
25.下列物质在常温下发生水解时,对应的离子方程式正确的是
![]() A.
Na2CO3:CO32-+2H2O H2O+CO2↑+ 2OH-
A.
Na2CO3:CO32-+2H2O H2O+CO2↑+ 2OH-
![]() B.
NH4Cl:NH4++H2O
NH3·H2O +
H+
B.
NH4Cl:NH4++H2O
NH3·H2O +
H+
![]() C.
CuSO4:Cu2++2H2O
Cu(OH)2↓+
2H+
C.
CuSO4:Cu2++2H2O
Cu(OH)2↓+
2H+
D. NaF:F-+H2O ===== HF + OH-
26.实验室在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需浓度,如此操作的目的是
A.防止硫酸铁分解 B.抑制硫酸铁水解C.提高硫酸铁的溶解度 D.提高溶液的pH
27.加硝酸或加入烧碱使下列离子浓度都减小的是
A. HCO3- B. Al3+ C. CH3COO- D. Ag+
28.下列说法中正确的是
A. HCO3-在水溶液中只有电离,不水解 B.硝酸钠溶液水解之后呈中性
C.可溶性的铝盐都能发生水解反应 D.可溶性的钾盐都不发生水解反应
![]() 29.当Mg(OH)2固体在水中溶解达到平衡时:Mg(OH)2
(s)
Mg2++2OH-,为使Mg(OH)2固体的量减少,可加入
29.当Mg(OH)2固体在水中溶解达到平衡时:Mg(OH)2
(s)
Mg2++2OH-,为使Mg(OH)2固体的量减少,可加入
A. NH4NO3 B. Na2S C. MgSO4 D. CH3COONa
30.下列各组离子中,在溶液中能大量共存的是
A. S2-、NO3-、CO32-、K+ B. CO32-、NH4+、K+、SO42-
C. Al3+、Na+、S2-、SO42- D. Fe2+、Ca2+、H+、NO3-
| 题目 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 题目 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(满分50分)
二、填空题(共37分)
31、已知T
K和P kPa时, 在容积为VL的密闭容器中充有1mol A和1molB,
保持恒温恒压, 使反应: A(气) + B(气) ![]() C(气)达到平衡时, C的体积分数为40%. 试回答下列有关问题:
C(气)达到平衡时, C的体积分数为40%. 试回答下列有关问题:
(1)与使温度和压强在上述条件下恒定不变, 在密闭容器中充入2mol A和2mol B, 则反应达到平衡时, 容器的体积为 ________, C的体积分数为 ___________.
(2)若另选一容积固定不变的密闭容器, 仍然控制温度为T K, 使1mol A和2mol B反应达到平衡状态时, C的体积分数仍然为40%, 则该密闭容器的体积为 ______.
32. 右图装置中, 容器甲中充入 0.1mol NO 气体, 干燥管内装有一定量的 Na2O2, 从甲处缓慢通入 CO2 气体. 恒温下, 容器甲中活塞缓慢由 B 向左移动, 当移至C处时, 容器体积缩小为最小, 为原容器体积的
![]() , 随着CO2 气体的继续通入, 活塞又渐渐地向右移动.
, 随着CO2 气体的继续通入, 活塞又渐渐地向右移动.
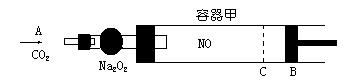
(1) ① 已知当活塞移动到 C 处时, 干燥管内物质的质量增加了 2.24 g, 此时通入标准状况下的CO2 气体多少L? 容器甲中NO2 转化成N2O4 的转化率为多少?
② 活塞移动到C处后, 继续通入amol CO2, 此时活塞恰好回到B处, 则a 值必小于 0.01, 请说明理由.
33、在硫酸工业中,通过下列反应使SO2氧化成SO3:
![]()
(1)在生产中,常用过量空气是为了 ;
(2)加热到400~500℃可以 ;
(3)尾气中的SO2必须回收是为了 ;
(4)反应时使用催化剂(V2O5)是为了 。
34、⑴ 298K时合成氨,每生成1 mol 氨气,同时放出46.2 kJ的热量。
则该反应的热化学方程式为: 。
在该温度下,取1molN2和3molH2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量总小于92.4kJ ,其原因是
。
⑵ 在通常情况下为何测定NO2的分子量高于理论值?
⑶ 相同条件下,酯类在酸性条件下的水解程度比在碱性条件下弱得多,原因是
![]() ⑷
牙齿表面受到一层硬的、组成为Ca5(PO4)3OH的物质的保护,它在唾液中存在下列平衡:Ca5(PO4)3OH 5Ca2++3PO43-+OH-,进食后细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是
⑷
牙齿表面受到一层硬的、组成为Ca5(PO4)3OH的物质的保护,它在唾液中存在下列平衡:Ca5(PO4)3OH 5Ca2++3PO43-+OH-,进食后细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是
。
35.某溶液中含有Cl-、Br-、CO32-、S2-、K+等五种离子。
(1)在常温下,该溶液的pH应 7(填“大于”、“小于”或“等于”)。
(2)若向该溶液中加入稍过量盐酸至pH=2,并煮沸, 离子将不再在溶液中。
(3)若向该溶液中加适量 溶液,充分振荡后过滤,滤液无上述各种阴离子,只有一种盐,这种盐是 。
36.在a、b两支试管中,分别装上形态相同、质量相等的一颗锌粒,然后向两支试管中,分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白:
(1)a、b两支试管中的现象:相同点是 ;不同点是 。原因是 。
(2)a、b两支试管中生成气体的体积开始时是a b,反应完毕后生成气体的总体积是a b,原因是 。
参考答案
1.D 2.A. 3.D.4.B 5.C 6.C 7.A 8.D.9.C 10.D 11. B 12. A.13. D.
14. B 15.A 16. C. 17. D 18.D 19.D 20.D 21.A22.D 23.C 24.D 25.B 26.B
27.A 28.C 29.A 30.A
二、填空题(每空一分,共37分)
31、(1) __10v/7(L)__, ____40%____.
(2) ___7.5v/7(L)__.
32. ①2Na2O2+2CO2 = 2Na2CO3+O2 ![]() m
m
2![]() 22.4L
88-32=56g
22.4L
88-32=56g
V(CO2)L 2.24g
V(CO2)=1.792L(0.08mol)
2NO +
O2 = 2NO2
2NO2 = N2O4 ![]() n
n
2 1 2 2 1 1
0.1 0.08/2 0.08mol ?=0.02 0.1![]() 9/10
NO2%=0.02/0.08=25%
9/10
NO2%=0.02/0.08=25%
② Na2O2已经耗完,通入CO20.01mol可以将活塞移动到C处,但相当减小压强,2NO2 = N2O4将逆反应方向移动。所以不需要通入0.01mol
33、:(1) 提高SO2的利用率, ;
(2) 提高反应速度,此时催化剂的催化活性最大。 ;
(3) 减少环境污染,节约原材料。 ;
(4) 加快反应速度,缩短达到平衡所需的时间 。
341/2N2(g)+3/2H2(g)=NH3(g) ![]() H=-46.2kJ/mol 。
H=-46.2kJ/mol 。
反应是可逆反应不可能进行到底 ,也就是不可能生成2摩的氨 。
⑵ 存在可逆反应:2NO2 = N2O4
⑶ 酯类水解生成羧酸和醇,在酸性条件下,容易达到平衡;而在碱性条件下,由于碱把羧酸转化为盐,减小了生成物浓度,使水解平衡向生成羧酸和醇的方向移动。
⑷ 有机酸与OH-反应生成水,使得平衡向着脱矿的方向移动 。
35.(1) 大于 (2), CO32-、S2- (3)AgNO3 KNO3 。
36. 产生气体,锌粒溶解 ; 生成H2的速率不同 。 盐酸是强电解质,醋酸是弱电解质 。
(2) 大于 等于 n(HCl)= n(HA c)随着反应进行醋酸将继续电离出H+ 。