《电离平衡》测试卷
科目:化学 单元:电离平衡
命题老师:张敏霞 日期:
一、选择题
1.下列物质的水溶液能导电,但不是电解质的有( )
①NH3 ②H2S ③Cl2 ④SO2 ⑤Na2O ⑥NO2 ⑦H2SO4 ⑧苛性钠
(A)①②⑤ (B)③⑥⑧ (C)①③④⑥ (D)②⑤⑥⑦
2.现有浓度为1 mol/L的五种溶液:①HCI,②H2SO4,③CH3COOH,④NH4Cl,⑤NaOH,由水电离出的[H+]大小关系正确的是( )
(A)④>③>①=⑤>② (B)①=②>③>④>⑤
(C)②>①>③>④>⑤ (D)④>③>①>⑤>②
3.下列物质的水溶液,能在蒸发皿中加热浓缩得到原物质的是( )
①NaAlO2,②FeCl3,③明矾,④绿矾,⑤KNO3,⑥H2S,⑦HCI,⑧蛋白质,⑨Na2SO3,⑩CaCl2。
(A)①③⑤⑥⑧⑩ (B)②③④⑤⑨⑩
(C)③⑤⑦⑩ (D)①③⑤⑩
4.以下关于胶体的叙述中正确的是( )
(A)胶体具有丁达尔现象,是最反映胶体与溶液本质的一种区别
(B)所有胶体的胶粒都是吸附着不同电荷的分子集合体
(C)采用电泳可确定胶粒的电性
(D)胶体中混有电解质溶液,可用先静置后倾斜的方法进行分离
5.将淀粉碘化钾溶液装在羊皮纸袋中,并将羊皮纸袋下半部浸泡在蒸馏水中,过一段时间后取该蒸馏水进行实验,下列现象能证明羊皮纸袋有破损的是( )
(A)加入碘水后液体变蓝色
(B)加入碘化钾溶液不变蓝色
(C)加入硝酸银溶液产生黄色沉淀
(D)加入溴水后液体变蓝色
6.下列事实能说明亚硝酸是弱电解质的是( )
(A)NaNO2溶液的pH大于7
(B)HNO2不与Na2SO4反应
(C)用HNO2做导电实验,灯炮很暗
(D)0.1 mol/L的HNO2溶液的pH值为2.1
7.在一定温度下,用蒸馏水稀释醋酸溶液,随着醋酸浓度的降低,下列始终保持增大趋势的量的是( )
(A)[H+] (B)H+个数
(C)CH3COOH分子数 (D)[H+]/[CH3COOH]
8.已知某温度0.1moL/L的NaHB强电解质溶液中[H+]>[OH-],则下列关系式一定正确的是( )
(A)[H+]+[Na+]=[HB-]+2[B2-]+[OH-]
(B)[Na+]=0.1 moL/L≥[B2-]
(C)[H+][OH-]=1×10-14
(D)溶液的pH=1
9.在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的[OH-]分别为Amol/L与Bmol/L.则A和B的关系为( )
(A)A>B (B)A=10-4B (C)B=10-4A (D)A=B
10.已知0.1 mol/LNaHCO3溶液的pH为8.4,0.1 moL/LNa2CO3溶液pH是11.4,则由NaHCO3水解产生的[OH-]是由Na2CO3水解产生的[OH-]的( )
(A)3倍 (B)1/3倍 (C)103倍 (D)10-3倍
11.25℃时,等体积硫酸和氢氧化钠溶液混合后,若溶液呈碱性,则混合前硫酸的pH值和氢氧化钠溶液的pH值之间应满足的关系是( )
(A)pH![]() +pHNaOH>14 (B)pH
+pHNaOH>14 (B)pH![]() +pHNaOH<14
+pHNaOH<14
(C)pH![]() +pHNaOH=14 (D)pH
+pHNaOH=14 (D)pH![]() +pHNaOH=13
+pHNaOH=13
12.将一定量盐酸和氨水混合后,溶液pH=7则原来的两溶液中氨和一水合氨与HCl的物质的量(分别用n1、n2表示)之间的关系为( )
(A)n1<n2 (B)n1=n2 (C)n1>n2 (D)以上都可能
13.将pH值相同的盐酸和醋酸稀溶液,分别用蒸馏水稀释至原体积时m倍和n倍后,两溶液的pH值仍然相同,则m和n的关系是( )
(A)m<n (B)m>n (C)m=n (D)无法确定
14.已知稀盐酸的物质的量浓度为amol/L,稀NaOH溶液浓度bmoL/L,当两种溶液等体积混合后,所得溶液的pH=2(混合液的体积视为原溶液体积的加合),则a和b的关系为( )
(A)a=b/2 (B)b=a/2 (C)a=b+0.02 (D)a=b+0.01
二、填空题
15.不溶于水的氧化亚铜(Cu2O),可溶于含有硫酸的Fe2(SO4)3,水溶液中,其化学方程式为Cu2O+Fe2(SO4)3+H2SO4=2CuSO4+2FeSO4+H2O。此时生成的FeSO4可用酸性KMnO4溶液(硫酸酸化)滴定,其化学方程式为:
10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3+K2SO4+2MnSO4+8H2O
用这种方法可以测定氧化亚铜的含量。由计算可知,每毫升0.1mol/L KMnO4溶液相当于________mg Cu2O。怎样证明上述滴定操作刚好达到滴定终点。
16.(1)现有①硫酸溶液、②醋酸溶液、③盐酸三种溶液
①当pH值相等时,三种酸的物质的量浓度由大到小的顺序是(用①②③表示)__________。
②当物质的量浓度相等时,三种酸溶液的pH值由小到大的顺序是(用①②③表示)_________。
③取pH值都等于3的①②③三种溶液各100mL,分别向其中加入10mLpH=12的Ba(OH)2,溶液,反应后pH值最小的是___________。
简答理由____________________________________________________。
(2)①在6份0.01 moL/L氨水中分别加入下列各物质:A.浓氨水,B.纯水,C.少量K2SO3固体,D.少量浓硫酸,E.少量NaOH固体,F.少量Al2(SO4)3,固体。
(a)能使[OH-]减小,使[NH![]() ]增大的是____________;(b)能使[OH-]增大,使[NH
]增大的是____________;(b)能使[OH-]增大,使[NH![]() ]减小的是________;(c)能使[0H-]和[NH
]减小的是________;(c)能使[0H-]和[NH![]() ]都增大的是_________;(d)能使[OH-]和[NH
]都增大的是_________;(d)能使[OH-]和[NH![]() ]都减小的 是______________。
]都减小的 是______________。
②25℃时用Pt电极电解500mL amol/L CuSO4溶液,试回答下列有关问题:
(a)写出两极的电极反应式:阳极____________,阴极__________。
(b)当电解到[Cu2+]为0.5a mol/L时,停止电解,若要使溶液恢复到与电解前相同的状态,可向溶液中加入适量的( )
(A)CuSO4粉末 (B)CuSO4·5H2O (C)CuO粉末 (D)Cu(OH)2
17.已知:(A)Cu2+,Fe2+在pH值为4~5的条件中不水解而Fe3+却几乎全部水解
(B)双氧水(H2O2)是强氧化剂,在酸性条件下,它的还原产物是H2O。用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下:
①取50毫升纯净的盐酸,加入一定量的粗CuO,加热搅拌,充分反应后过滤,经测定溶液的pH值是3
②向滤液中加入双氧水,搅拌。
③向②中加入过量纯CuO,微热,搅拌,此时测定溶液的pH值为4,过滤。
④把③所得滤液浓缩。
填空:
(I)②中发生反应的离子方程式是__________________________________。
(Ⅱ)③中过滤后滤渣的成分是____________________________________。
(Ⅲ)④浓缩过程中的溶液颜色变化是:________________________________。
(Ⅳ)③中pH值升高的原因是:______________________________________。
18.(Ⅰ)A、B均是盐,由A溶液和B溶液出发,可发生下图所示的一系列变化(各步所加试剂均足量)
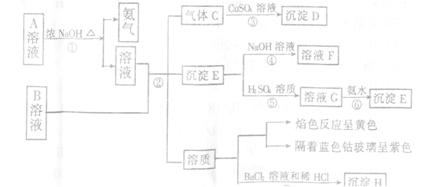
根据实验,回答有关问题:
(1)写出反应④和⑥的离子方程式
 (2)写出A和B的化学式A__________,B______________。
(2)写出A和B的化学式A__________,B______________。
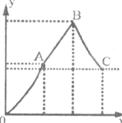
(Ⅱ)向100mL 3mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴加入
1mol·L-1Ba(OH)2溶液。
(1)写出当刚好出现沉淀物质的量总量的最大值时的离子方程式(用一个式子表示):____________。
(2)随着Ba(OH)2溶液体积的变化,沉淀总物质的量的变化如右图所示(Y代表沉淀总物质的量/mol;X代表Ba(OH)2溶液体积/mL)。写出B点和C点所对应的Ba(OH)2溶液的体积:B_____________,C______________。
三、计算题
19.将mg铁粉在500mL pH=1的盐酸中完全溶解,向溶液中通入适量的氯气,恰好完全反应后,再加入0.02mol/L的NiIx溶液500mL时,刚好使I-转变为I2析出,此时溶液的pH=2。已知反应前后Nix+的化合价没有变化,反应过程中溶液体积的变化可以忽略。试通过计算求(1)m值。(2)x值。
20.取等物质的量浓度的NaOH溶液两份,每份为50mL。向其中各通入一定量的CO2,随后分别各取溶液10mL,将其稀释成100mL;并分别向稀释后的溶液中逐滴加入0.1mol·L-1的HCl溶液,产生的CO2气体体积(标准状况)与所加入盐酸的体积之间的关系如下图所示:(设分别为A、B两种情况)。
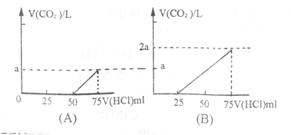
回答下列问题:
(1)在(A)情况下,溶质为(写化学式)__________,其物质的量之比为__________,在标准状况下CO2气体的体积为____________。
(2)在(B)情况下,溶质为(写化学式)________________,其物质的量之比为______,在标准状况下CO2气体的体积为____________。
(3)原NaOH溶液的物质的量浓度为____________。
参 考 答 案
一、1.C 2.A 3.D 4.C 5.AD 6.AD 7.BD 8.AB 9.B 10.D 11.A 12.C 13.A 14.C
二、15、36mg,再滴一滴酸性KMnO4溶液,锥形瓶中溶液变为紫色,且半分钟内不再褪色,就表明达到终点。
16.(1)②③①,①③②,②,①③提供的H+与Ba(OH)2恰好反应完全,溶液呈中性,而②中CH3COOH过量,所以呈酸性。(2)DF,CE,A,B,4OH—4e=O2↑+2H2O,2Cu2++4e=2Cu,C
17.2Fe2++H2O2+2H+=2Fe3++2H2O,CuO,Fe(OH)3,由蓝色变绿色,CuO+2H+=Cu2++H2O
18.Al(OH)3+OH-=AlO![]() +2H2O,Al3++3NH3·H2O=Al(OH)3↓+3NH
+2H2O,Al3++3NH3·H2O=Al(OH)3↓+3NH![]() ,(NH4)2S,KAl(SO4)2,
,(NH4)2S,KAl(SO4)2,
Al3++2SO![]() +NH
+NH![]() +2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3·H2O,600ml,750ml
+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3·H2O,600ml,750ml
19.m为1.12g,x为2
20.(1)NaOH,Na2CO3,1∶1,56ml;(2)Na2CO3,NaHCO3,1∶1,112ml;(3)0.75mol/L