《化学平衡》试卷
(时间:50分钟。满分100分)
可能用到的相对原子质量: H: 1 O: 16 N: 14 Na: 23 Cl: 35.5 C: 12
一、选择题(下列各题只有一个选项符合题意。每小题4分,共60分。请将答案填在答题卡上)
1.下列措施,一定不能加快化学反应速率的是
A.增大压强 B.升高温度 C.加催化剂 D.增大体积
![]() 2. 对于反应:4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g),
下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是
2. 对于反应:4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g),
下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是
A.v(NH3)= 0.2mol·L-1·s-1 B.v(O2 )= 0.24 mol·L-1·s-1
C.v(H2O )= 0.25 mol·L-1·s-1 D.v(NO) = 0.15 mol·L-1·s-1
![]() 3.在N2+3H2 2NH3的反应中,经过t秒钟后,NH3的浓度增加了0.6mol/L,在此期间,正反应速率v(H2)=0.45mol/(L·s),则t值为:
3.在N2+3H2 2NH3的反应中,经过t秒钟后,NH3的浓度增加了0.6mol/L,在此期间,正反应速率v(H2)=0.45mol/(L·s),则t值为:
A.1秒 B.1.5秒 C.2秒 .D.2.5秒
![]() 4.在密闭容器中通人一定量的HI气体,使其在一定条件下发生反应:2HI(g) H2(g) +I2 (g) 。下列叙述中一定属于平衡状态的是:
4.在密闭容器中通人一定量的HI气体,使其在一定条件下发生反应:2HI(g) H2(g) +I2 (g) 。下列叙述中一定属于平衡状态的是:
A.HI、H2、I2的浓度相等 B.混合气体的颜色不变化时
C.混合气体的总压不变时 D.v(HI):v(H2):v(I2)=2:1:1时
![]() 5.密闭容器中,反应xA(g) + yB(g) zC(g)达平衡时,A的浓度为0.5mol/L, 若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是:
5.密闭容器中,反应xA(g) + yB(g) zC(g)达平衡时,A的浓度为0.5mol/L, 若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是:
A.x+y < z B.平衡向正反应方向移动
C.B的转化率降低 D.A的体积分数下降
6.向0.1mol/L氨水中逐渐加入一定量的水,始终保持增大趋势的是
A.NH3·H2O的浓度 B.OH -的浓度
C.NH4+ 的数目 D.NH4+的浓度
7.下列可逆反应中,正反应是吸热反应的是
![]() A.2NO2 (g) N2O4(g),降温,颜色变浅
A.2NO2 (g) N2O4(g),降温,颜色变浅
![]() B.NO2+SO2 NO+SO3,降温,SO3的体积分数增加
B.NO2+SO2 NO+SO3,降温,SO3的体积分数增加
![]() C.CS2+2H2O CO2+2H2S,升温,CO2的平衡浓度增大
C.CS2+2H2O CO2+2H2S,升温,CO2的平衡浓度增大
![]() D.PCl3+Cl2 PCl5,降温,PCl3转化率增大
D.PCl3+Cl2 PCl5,降温,PCl3转化率增大
![]() 8.
8.![]() 在可逆反应2SO2(g)+O2(g)
在可逆反应2SO2(g)+O2(g)![]() 2SO3(g)+Q (△H<0) 达到新平衡时,在平衡体系中充入一定量的18O2,当达到新平衡时,18O的原子应存在于
2SO3(g)+Q (△H<0) 达到新平衡时,在平衡体系中充入一定量的18O2,当达到新平衡时,18O的原子应存在于
A.只能存在于O2的分子中 B.只能存在于SO3的分子中
C.能同时存在于SO2和O2的分子中 D.能同时存在于SO2、O2、SO3分子中
9.在25℃、1.01×105Pa状态下,相同容积的甲、乙两个密闭容器,甲中盛放N2,乙中盛放NO2和N2O4混合气体。若将甲、乙两容器同时冷却降温到0℃,则此时甲、乙两容器内的压强关系是
A.P甲>P乙 B.P甲<P乙 C.P甲=P乙 D.P甲=P乙=1.01×105Pa
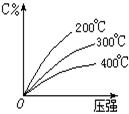 10. 反应aA(g)+b(B)(g)
10. 反应aA(g)+b(B)(g) ![]() c(C)(g);△H=Q。生成物C的质量分数与压强P和温度的关系如图,方程式中的系数和Q值符合图象的是
c(C)(g);△H=Q。生成物C的质量分数与压强P和温度的关系如图,方程式中的系数和Q值符合图象的是
A.a+b>c Q>0
B.a+b>c Q<0
C.a+b<c Q<0
D.a+b=c Q>0
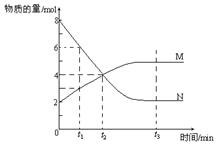 11.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
11.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
A.反应的化学方程式为:2 M![]() N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
12.下列能用勒沙特列原理解释的是
①棕红色NO2加压后颜色先变深后变浅 ②.FeCl3溶液加热后颜色加深 ③.Fe(SCN)3溶液中加入固体KSCN后颜色变深 ④氯水宜保存在低温、避光条件下 ⑤乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利 ⑥. SO2催化氧化成SO3的反应,往往加入过量的空气
⑦向AgCl悬浊液中加入KI溶液有黄色沉淀生成
A.①②⑤⑥ B.②③④⑦. C.①③⑤⑦ D.全部
![]() 13.在恒温恒容的容器中进行反应N2O4(g) 2NO2(g);△H>0,若反应物浓度由0.1mol/L
13.在恒温恒容的容器中进行反应N2O4(g) 2NO2(g);△H>0,若反应物浓度由0.1mol/L
降到0.06mol/L需20s,那么,反应物浓度由0.06mol/L降到0.024mol/L,需反应的时间为
A.等于18s B.等于12s C.大于18s D.小于18s
![]() 14.某温度下,在一容积可变的容器中,反应2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
14.某温度下,在一容积可变的容器中,反应2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
A.均减半 B.均加倍 C.均增加1 mol D.均减少1 mol
15.将N2、H2以体积比1:1混合均匀,分成三等份,分别充入甲、乙、丙三个装有相同催化剂且容积不变的真空密闭容器中,在相同温度下使其分别达到化学平衡.已知平衡时甲中N2的转化率为20%,乙中H2的转化率为30%,丙中混合气体的平均相对分子质量为16,则有关三容器内反应的叙述不正确的是
A.起始时反应速率相同
B.平均反应速率的大小是甲﹥乙﹥丙
C.平衡时容器中的压强是丙﹥乙﹥甲
D.平衡时,NH3的体积分数丙中比甲中大
班级 姓名 成绩
选择题答题卡
| 1 |
| 2 |
| 3 |
| 4 |
| 5 |
| 6 |
| 7 |
| 8 |
|
| 9 |
| 10 |
| 11 |
| 12 |
| 13 |
| 14 |
| 15 |
|
| |
二、填空题(共24分)
16.(15分)Ⅰ、恒温、恒压下,在一个可变容积的容器中发生如下反应:
A(g)+B(g)![]() C(g)
C(g)
(1)若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为 mol
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol
(3)若开始时放入xmolA、2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3amol,则x= ,y= 。平衡时B的物质的量为 (选填一个编号)
(甲)大于2mol (乙)等于2mol
(丙)小于2mol (丁)可能大于、等于或小于2mol
作出此判断的理由是 。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是
。
Ⅱ、若维持温度不变,在一个与(1)反应前起给体积相同、且容积固定的容器中发生上述反应
(5)开始时放入1molA和1molB,到达平衡后生成bmolC,将b与(1)小题中的a进行比较 (选填一个编号)
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出断判断此的理由是 。
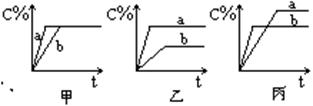 17.(3分)现有可逆反应A(气)+B(气)
17.(3分)现有可逆反应A(气)+B(气)![]() 3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则_ _ 曲线是表示有催化剂时的情况。
(2)若乙图中的a曲线表示200℃和b曲线表示100℃时的情况,则此可逆反应的正反应是_ __ __热反应。
(3)若丙图中两条曲线分别表示不同压强下的情况,则__ __曲线是表示压强较大的情况。
![]() 18.(6分)在10℃和4×105Pa的条件下,当反应aA(g) dD(g) +
eE(g)建立平衡后,维持温度不变,逐步增大体系的压强,在不同压强下该反应建立平衡后,物质D的浓度见下表(在增大压强的过程中无其它副反应发生):
18.(6分)在10℃和4×105Pa的条件下,当反应aA(g) dD(g) +
eE(g)建立平衡后,维持温度不变,逐步增大体系的压强,在不同压强下该反应建立平衡后,物质D的浓度见下表(在增大压强的过程中无其它副反应发生):
| 压强(Pa) | 4×105 | 6×105 | 1×106 | 2×106 |
| D的浓度(mol/L) | 0.085 | 0.126 | 0.200 | 0.440 |
(1)压强从4×105 Pa增加到6×105 Pa时平衡应向 反应方向移动(填“正”或 “逆”),理由是 。
(2)压强从1×106 Pa 增加到2×106 Pa时,平衡向 反应方向移动(填“正”或 “逆”).理由是 。
三、简答题(共6分)
19.(3分)今年是勒沙特列(Le Chatelier1850-1936)诞生153周年。请用勒沙特列原理解释如下生活中的常见现象:打开冰镇啤酒瓶把啤酒倒入玻璃杯,杯中立即泛起大量泡沫。
![]() 20.(3分)已知N2(气)+3H2(气) 2NH3(气) (正反应为放热反应)。为什么在合成氨工厂,通常采用20MPa –50MPa的压强和500℃左右的温度?
20.(3分)已知N2(气)+3H2(气) 2NH3(气) (正反应为放热反应)。为什么在合成氨工厂,通常采用20MPa –50MPa的压强和500℃左右的温度?
四、计算题(共10分)
![]() 21.(4分)在一定条件下,可逆反应A2+B2 2C,达到化学平衡状态,经测得平衡时:c(A2)=0.5 mol /L,c(B2)=0.1 mol /L,c(C)=1.6 mol /L,若A2,B2,C的起始浓度分别用amol/L,bmol/L,cmol/L表示,要维持相同的平衡状态,请回答:
21.(4分)在一定条件下,可逆反应A2+B2 2C,达到化学平衡状态,经测得平衡时:c(A2)=0.5 mol /L,c(B2)=0.1 mol /L,c(C)=1.6 mol /L,若A2,B2,C的起始浓度分别用amol/L,bmol/L,cmol/L表示,要维持相同的平衡状态,请回答:
(1)a,b应满足的关系是:
(2)a的取值范围是: 。
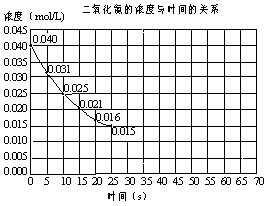 22.(6分)二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L)。右图中的曲线表示二氧化氮分解反应在前25秒内的反应进程。
22.(6分)二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L)。右图中的曲线表示二氧化氮分解反应在前25秒内的反应进程。
(1)请计算前20秒内氧气的平均
生成速率 。
(2)若反应延续至70秒,请在图中用实线画出25秒至70秒的反应进程曲线。
(3)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加催化剂后的反应进程曲线。
《化学平衡》参考答案
| 1 | D | 2 | A | 3 | C | 4 | B | 5 | C | 6 | C | 7 | C | 8 | D |
| 9 | A | 10 | B | 11 | D | 12 | D | 13 | C | 14 | C | 15 | D |
| |
16.(1)(1-a) (2)3a (3)2 3-3a 丁
若3a>1,B的物质的量小于2mol;若![]() ,B的物质的量等于2mol;
,B的物质的量等于2mol;
若3a<1,B的物质的量大于2mol
(4)![]()
(5)乙 因为(5)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(5)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后a>b。
17.(1)a
(2)吸
(3)b
18.(1)逆,D浓度增大的倍数(0.2/0.085=2.4)小于压强增大的倍数(1×106/4×105=2.5) .(2)正;D的浓度增大倍数(0.44/0.20=2.2)大于压强增大的倍数(2×106/1×106=2)。
19.打开冰镇啤酒瓶把啤酒后,一方面减小了压强,另一方面升高了温度,二者均可使CO2的溶解度降低(或使溶解平衡逆向移动)。
20.加压有利于增大反应速率,又可使平衡向右移动,但过大会对材料、设备及制造提出更高的要求;升温有利于加速反应,但不利于化学平衡向右移动,但为了提高反应速率,同时考虑催化剂的活性,故通常采用20MPa –50MPa的压强和500℃左右的温度。
21.(1)a= b +0.4
(2)0.4<a<1.3
22.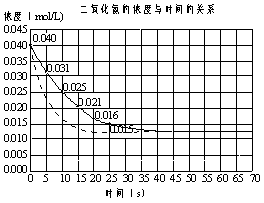 (1)6×10-4mol/(L·s)
。
(1)6×10-4mol/(L·s)
。
(2)如图实线.
(3)如图中虚线〔必须在(45,0.0125)点处相交〕.