初三化学水和氢气 (第9周)
【教学内容】
本周主要进行第二章复习及学习第三章中的水和氢气
1.第二章知识系统整理。
2.了解水的存在和作用;水的性质和组成。
3.学习氢气的实验室制法。
4.学习氢气的性质和用途。
【教学目标】
1.通过对第二章知识系统的整理,进一步掌握有关物质结构、物质分类方面的初步知识。
2.了解水在自然界的存在和作用,明确水是人类的宝贵的自然资源,同时了解造成水污染的原因、危害、防治,进一步增强环境保护意识。
3.记住水的物理性质和水发生分解反应的化学性质,通过电解水的实验明确水的组成。
4.掌握实验室制取氢气的反应原理、仪器装置、收集方法。
5.记住置换反应和原子团的概念,会正确书写常见原子团的化学式。
6.掌握氢气的主要物理性质和化学性质以及氢气的用途。
7.理解点燃氢气前必须检验纯度的原因,掌握验纯的方法。
8.掌握氢气还原氧化铜实验的操作要点、并从该反应了解还原反应和还原剂的概念。
【知识讲解】
1.![]() 第二章知识系统
单质
第二章知识系统
单质
![]() 存在状态—
存在状态—
![]() 组成—元素
化合物
组成—元素
化合物
表示方法—元素符号(宏观意义:表示一种元素;
微观意义:表示该元素的一个原子。)
![]()
![]() 原子核—— 质子(核电荷数=核内质子数)
原子核—— 质子(核电荷数=核内质子数)
![]() —结构—
中子
—结构—
中子
![]() 原子
核外电子
(核内质子数=核外电子数)
原子
核外电子
(核内质子数=核外电子数)
—表示方法—元素符号 (元素符号前面的数字表示原子个数)
结构 —相对原子质量—原子量 (原子量=质子数+中子数)
![]()
![]() 由同种或不同种原子构成
式量计算
由同种或不同种原子构成
式量计算
物质 分子 表示方法—化学式—根据化学式的计算 化合物中元素质量比计算
化合物中元素质量分数的计算
相对质量—式量
![]() 变化 物理变化——分子没有变化
变化 物理变化——分子没有变化
化学变化——分子起了变化即分子分解成原子,原子重新组合产生新的分子。
![]()
![]() 混合物
金属
混合物
金属
![]() 分类
单质— 非金属
分类
单质— 非金属
稀有气体
纯净物—
请见下页
—
![]() 金属氧化物
金属氧化物
![]() 氧化物
氧化物
化合物— 酸 非金属氧化物
碱
盐
2.怎样描述不同物质的宏观组成和微观构成?
| 物 质 | 宏观组成 | 微观构成 |
| 各种金属,如铁 | 铁由铁元素组成 | 铁由铁原子构成 |
| 碳硅,如碳 | 碳由碳元素组成 | 碳由碳原子构成。 |
| 稀有气体,如氖气 | 氖气由氖元素组成 | 氖气由氖原子(或氖分子)构成 |
| 气态非金属,如氧气 | 氧气由氧元素组成 | 氧气由氧分子构成,每个氧分子由两个氧原子构成。 |
| 二氧化碳 | 二氧化碳由碳、氧 两元素组成 | 二氧化碳由二氧化碳分子构成,每个二氧化碳分子由一个碳原子、两个氧原子构成。 |
3.为什么说水是人类宝贵的自然资源?
(1) 水在自然界的分布虽然很广(包括海洋水、地下水、冰川、河流、湖泊及大气水、
生物水)地球表面3/4 被水覆盖,人体含水约占人体质量的2/3。但对人类来说,地球又
是缺水的,联合国统计资料表明,地球中淡水约占地球总水量的2.6% ,而地面淡水量
还不到总水量的1%,且这些淡水在时间和地区上分布还不平衡,故地球上淡水匮乏,
淡水资源是宝贵的。
(2) 水是生命的源泉。没有水就没有生命。水是生命产生、存在、发育和繁殖的基本前
提。没有水也没有现代文明社会。水与农业生产及人们的日常生活关系密切。任何作物
生长、任何工业生产都离不开水,人们的一切活动也都离不开水,所以说水与人类的关
系密切。
(3) 全球性的水资源短缺和水被污染问题日益严重使人类越来越清醒地认识到水是人类
宝贵的自然资源,应该合理开发利用和保护水资源。
4. 工业生产中的废渣、废水、废气和生活污水的任意排放,农业生产中施用化肥、农
药随雨水流入江、河、湖水中都造成水的污染。受污染的水危及人和动物的生命,危害
工农业生产;降低产品质量和产量,且使地球上能利用的淡水资源更加缺乏,因此需采
取各种科学方法预防和消除对水源的污染,保护和改善水质,人人增强环境保护意识,
人人珍惜每一滴水。
5.纯净的水是无色、无气味、无味道的液体。101千帕时,凝固点是00C,沸点是
1000C,40C密度最大,为1克/厘米3,冰的密度比水小。
![]() 6.
正极:有气泡产生,气体汇集后的体积小,该气体能使带火星的木条复燃
6.
正极:有气泡产生,气体汇集后的体积小,该气体能使带火星的木条复燃
![]() 水 直流电
——O2
水 直流电
——O2
负极:有气泡产生,气体汇集后的体积大,该气体具可燃性。
(与空气混合,点燃时有爆鸣声)——H2
①同温同压时 VH2 :Vo2 =2:1 (V表示气体体积)
![]() ②水通电发生反应的文字表达式:水 通电 氢气+氧气
②水通电发生反应的文字表达式:水 通电 氢气+氧气
③该实验说明:水是由氢元素和氧元素组成的化合物(因为生成物氢气由氢元素组成,
氧气由氧元素组成,故反应物水是由氢元素和氧元素组成)
④该反应的实质是构成水的水分子里的氢原子和氧原子先分开、又重新组合生成氢分子
和氧分子。所以电解水的实验验证:在化学反应里,分子可以分成原子,而原子却不
能再分。
⑤精确实验测定,每个水分子是由两个氢原子和一个氧原子构成的,水的化学式为H2O。
![]() 7.
工业制法:用水、天然气(主要成分CH4)、水煤气(CO和H2)作原料
7.
工业制法:用水、天然气(主要成分CH4)、水煤气(CO和H2)作原料
![]()
![]() 反应原理:锌+硫酸(稀) 硫酸锌+氢气(置换反应)
反应原理:锌+硫酸(稀) 硫酸锌+氢气(置换反应)
![]() 制法
Zn H2SO4
ZnSO4
H2
制法
Zn H2SO4
ZnSO4
H2
实验室制法 实验装置:常温下,固体与液体反应的装置(课本P50图)
![]() 排水集气法(H2难溶于水)
排水集气法(H2难溶于水)
收集方法
向下排空气法(H2密度比空气小得多)
![]() 难溶于水
难溶于水
![]() 物理性质
物理性质
密度比空气小得多
![]() 氢气
氢气
![]() 性质
可燃性:氢气+氧气 点燃 水
性质
可燃性:氢气+氧气 点燃 水
(点燃纯净的氢气、安静地燃烧;点燃混有空气的氢气,
化学性质 爆炸(或爆鸣))
![]() 还原性:氢气+氧化铜 △ 铜+水
还原性:氢气+氧化铜 △ 铜+水
(氧化铜由黑变红,管口有水滴)
用途:作探空气球(密度小),高能燃料、产生氢氧焰焊接或切割金属(可燃性)
冶炼金属钨、钼等,作保护气(还原性),另外,制盐酸、合成氨气。
检验:点燃,只生成水(或与空气混合、点燃时有爆鸣声)
8. 一种单质跟一种化合物起反应,生成另一种单质和另一种化合物的反应,叫置换反
应。置换反应属于化学反应的基本类型。
由两个或两个以上不同原子结合在一起,在许多化学反应中作为一个整体参加反
应,好象一个原子一样,这样的原子集团叫原子团。如“OH”氢氧根,“NO3”硝
酸根“ClO3”,氯酸根,“SO4”硫酸根,“CO3”碳酸根,“NH4”铵根,“MnO4”
高锰酸根等。
9. 氢气的爆炸极限为4-74.2%。即空气和氢气的混合气体100体积中含氢气
4-74.2体积,遇明火发生爆炸,低于或高于这个浓度范围,遇明火不会爆炸。
所以点燃氢气前一定要先检验氢气的纯度。方法是:用排水集气法收集一试管氢气。管
口向下移近酒精灯火焰,发出尖锐的爆鸣声表明氢气的不纯,发出响声很小,表明氢气
纯净。
10. 氢气还原氧化铜实验的操作要点归纳为:实验开始先通氢(已验纯的H2),排除空气
再点灯,变红有水先熄灯,试管冷后再停氢。为什么要这样做?
先点后通要爆炸(加热混有空气的氢气可能要爆炸)
先停后熄要氧化(还原生成的灼热的铜被进入试管的空气中的氧气氧化)
![]() 在氢气+氧化铜 △ 铜+水的反应中,氧化铜失去氧变成单质铜,我们说氧化铜发
在氢气+氧化铜 △ 铜+水的反应中,氧化铜失去氧变成单质铜,我们说氧化铜发
生了还原反应。这种含氧化合物里的氧被夺去的反应叫还原反应。
在这个反应中是谁使氧化铜被还原成铜的呢?是氢气,氢气夺取了氧化铜里的氧,所
以氢气是还原剂,具有还原性。在反应中使含氧化合物发生还原反应的物质叫还原剂。
【能力训练】
1.已知电解水生成氢气和氧气的体积比在同温同压时是2:1。标准状况下ρH2=0.0899克/升 ρO2=1.429克/升。精确实验测得水的式量为18,试确定水的化学式。
2.下图是简易的电解水的装置:(1)在图括号中写出电源两极的名称。
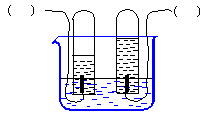 (2)给水通直流电时,电极上都有
产生(现象)
(2)给水通直流电时,电极上都有
产生(现象)
正极产生 (写气体的化学式,以下同),
负极产生 ,正负两极产生的气体在同温同
压时的体积比为 。
3.写出符合下列要求的文字表达式,并在物质名称下面写出化学式。
(1)有水生成的化合反应 (2)有水生成的分解反应
(3)有水生成的置换反应 (4)有水参加的分解反应
4.![]() 氢气+氧气
点燃
水 在什么条件下发生 (1)安静地燃烧 (2)发生爆炸
氢气+氧气
点燃
水 在什么条件下发生 (1)安静地燃烧 (2)发生爆炸
(3)发生爆鸣 分别说明为什么?
5.通过什么事实可证明自来水不是纯水?
6.氢气还原氧化铜的实验操作过程有以下六步。请按实验的先后顺序,将它们的编号填入括号中(用1、2、3、……编号)
( )将试管固定在铁架台上,使试管口微向下倾斜
( )继续通入H2,直至试管冷却
( )给试管内的氧化铜加热
( )停止加热
( )在干燥的硬质试管底部铺一层黑色的氧化铜
( )通入经验纯后的氢气
7.下列变化不属物理变化的是( )
A、水加热时产生气泡 B、向水中通入氧气
C、将水通直流电 D、冰块放入水中后慢慢消失
8.下列说法正确的是( )
A、若一种物质发生分解反应,产物中有水生成则可证明该物质中一定有氢、氧元素
B、水的污染主要来自城市生活污水的任意排放
C、水中氢氧元素的最简质量比是2:1 D、水能溶解所有的物质
9.水是由( )
A、2体积氢气和1体积氧气组成的混合物 B、水分子构成的纯净物
C、2个氢原子和1个氧原子构成的氧化物 D、2个氢元素和1个氧元素组成的化合物
10.18克水中所含氧元素的质量与A克氧气中所含氧元素质量相同,则A值为( )
A、32 B、8 C、36 D、16
11.实验室制氢气选用的一组最佳药品是( )
A、铁屑、稀盐酸 B、锌粒、稀硫酸 C、锌粒、浓硫酸 D、铜片、稀硫酸
12.下列说法正确的是( )
A、氢气是最轻的气体。(同温同压时) B、氢气是由两个氢原子构成的。
C、氢气通过灼热的氧化铜时,氢气被还原生成水
D、氢气和氧气混合后点燃,一定发生爆炸。
13.下列物质中含有氢分子的是( )
A、H2O2 B、固态氢 C、H2S D、电解水的正极产物
14.有反应A+B=C+D,如果A和D都是单质,B和C都是氧化物,则在这个反应中
( )
A、A是还原剂,B被氧化 B、A是还原剂,A被氧化
C、B是还原剂,被还原成D D、A是氧化剂,有氧化性
15.下列说法是否正确?(用“√”或“×”表示正确与否)
(1)一种单质和一种化合物发生的反应,一定是置换反应
(2)实验室用锌置换出稀硫酸中的氢气
(3)因为镁与稀硫酸反应太快,铁与稀硫酸反应太慢,故实验室用锌跟稀硫酸反应制
氢气
(4)在电解水时,必须通直流电,若通交流电,水根本不能分解。
(5)纯净的水是单质,而不纯净的水是混合物
(6)用向下排空气法收集氢气时,没有适宜的方法进行验满,所以要适当延长收集时
间。
【能力训练答案】
1.解:同温同压时,VH2:VO2=2:1,而生成物H2与O2的质量比即是反应物水
中氢氧元素的质量比。
∴ 水中氢、氧元素的质量比为![]()
水分子中H、O原子个数比:![]()
设水的化学式为HxOy ,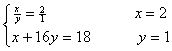
∴水的化学式为H2O
2.(1)左边负极,右边正极 (2)气泡 O2 H2 1:2
![]()
![]() 3.(1)氢气+氧气 点燃 水 (2)碱式碳酸铜 △ 氧化铜+二氧化碳+水
3.(1)氢气+氧气 点燃 水 (2)碱式碳酸铜 △ 氧化铜+二氧化碳+水
H2 O2 H2O
![]()
![]() (3)氢气+氧化铜 △ 铜+水 (4)水 通电 氢气+氧气
(3)氢气+氧化铜 △ 铜+水 (4)水 通电 氢气+氧气
4.答:(1)纯净的氢气在空气中或氧气中安静地燃烧,因为导管口导出的纯氢气流与
周围少量的氧气接触,反应产生热量少,且热量散失快。
(2)若H2与O2或空气混合,使氧分子与氢分子充分接触,点燃以后反应可以
迅速发生,并在短时间内放出大量的热,生成气体受热急速膨胀,在有限空间
内就会发生爆炸。
(3)若H2和O2或空气混合气体的反应在大口容器内发生,产生急速膨胀的气
体就会冲出容器,形成空气振动,就发生爆鸣。
5.答:加热煮沸水的过程中,会出现水垢。(这是因为水中含有少量其它可溶性物质,
在加热过程中发生变化,生成难溶性物质,从水中沉淀下来的缘故)
6.② ⑥ ④ ⑤ ① ③
7.C 8.A 9.B 10. D 11. B 12. A 13. B 14. B
15. (1)× (2)× (3)√ (4)× (5)× (6) √
(其中(4)通交流电,水也能分解,但因为交流电电流方向不固定,所以电极产物也
不固定,H2和O2混在一起,一方面不便于检验产物,另一方面容易引起爆鸣或爆炸
而带来危险。所以电解水时均用直流电。)