新课程高三化学综合测试题(5)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共150分。考试时间120分钟。
相关相对原子质量:H 1 C 12 N 14 O 16 Na 23 Fe 56
第Ⅰ卷(选择题 共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.据报道某些不合格大理石装潢材料中会产生放射性同位素氡![]() Rn,从而对人体产生伤害,
Rn,从而对人体产生伤害,
该同位素原子中的中子数和质子数之差为 ( )
A.136 B.50 C.88 D.222
2.第二次世界大战期间,某国的一支侦察小分队用十多只涂有化学药剂的老鼠完成了炸毁
某军工厂的任务,据你推测这种药剂是 ( )
A.TNT B.红磷和三硫化二锑
C.黑火药和甘油 D.白磷和CS2溶液
3.用干燥的烧瓶集满一瓶氯化氢气体做喷泉实验,没有看到喷泉现象,下列哪种操作为导
致实验失败的主要原因 ( )
A.水中没有加石蕊 B.装置的气密性不好
C.烧瓶中收集的氯化氢较多 D.连接烧瓶与烧杯的导管较短
4.下列变化一定属于化学变化的是 ( )
①紫色石蕊变红色 ②气体爆炸 ③无水硫酸铜变成硫酸铜晶体 ④发光发热
⑤O2转变成O3
A.①②③ B.①③④ C.③④⑤ D.①③⑤
5.下列实验现象描述不正确的是 ( )
A.一瓶98%的硫酸敞口放置一段时间后,质量增加
B.将一瓶饱和的浓氨水打开瓶盖后会产生白雾
C.常温下一个不与任何物质反应的小球在水中悬浮,该小球放入CCl4中沉到底部
D.可用湿润的淀粉碘化钾试纸放在集气瓶口观察氯气是否集满
6.下列关于臭氧的说法错误的是 ( )
A.它与氧气是氧的同素异形体
B.具有强氧化性,可做脱色剂或消毒剂
C.可在高压放电条件下由氧气制备
D.臭氧层中含有大量臭氧,可以吸收紫外线,是人类和生物的保护伞
7.下面一些报道中,你认为科学的是 ( )
A.疏通煤气管道时,充入氩气引起爆炸
B.新粉刷过石灰浆的墙壁释放出CO2使一老汉窒息而死
C.有易燃易爆物的工作场所,严禁穿化纤类衣服
D.本饮料纯天然,绝对不含化学物质
8.下列说法中不正确的是 ( )
A.新型无机非金属材料,具有光学特性,具有生物功能,具有电学特性,能承受高温,强度高
B.高温结构陶瓷比金属材料具有更多优点,如不怕氧化,密度小等优点
C.光导纤维作为通讯材料,有许多优点,但怕腐蚀,铺设也很不方便
D.光导纤维除用于通讯外,还可以用于医疗信息处理等许多方面
二、选择题(本题包括10小题,每小题4分,共40分;每小题有一个或两个选项符合题意。
若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一
个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.下列各分子为直线型且分子中各原子都满足8电子稳定结构的是 ( )
A.BeCl2 B.CCl4 C.CO2 D.SO2
10.常温下,按下列操作进行实验,所得溶液的pH一定等于7的是 ( )
A.将10 mL pH=5的稀盐酸加水稀释到100 mL
B.0.1 mol·L-1的某二元酸和0.1 mol·L-1的某二元强碱等体积混合
C.pH=2的某一元酸和pH=12的某一元碱等体积混合
D.pH=2的某二元强酸和pH=12的某一元强碱等体积混合
11.下列说法正确的是 ( )
A.我国从唐代时期开始就能生产陶瓷
B.化学实验的坩埚、蒸发皿都是陶瓷制品
C.水泥、陶瓷的生产过程都需要混合、成型、干燥、烧结、冷却
D.水泥、玻璃、陶瓷的制品都是属于混合物
12.下列说法错误的是 ( )
A.材料是按化学组成或状态、性质、效应、用途分类的
B.橡胶、化纤属于有机高分子材料
C.信息材料主要包括液晶高分子、光导纤维、光导体等
D.陶瓷属于金属材料
13.下列离子方程式的书写错误的是 ( )
A.金属钠与水反应Na+H2O====Na++OH-+H2
B.醋酸与氨水混合CH3COOH+NH3·H2O====CH3COO-+NH4++H2O
C.碳酸氢钙溶液中滴加少量澄清的石灰水Ca2++HCO3-+OH-====CaCO3↓+H2O
D.稀硫酸中滴加氢氧化钡2H++SO42-+Ba2++2OH-====BaSO4↓+2H2O
14.已知下列物质在一定条件下氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO4-→Mn2+;
Cl2→Cl-;HNO3→NO。如果分别用等物质的量这些物质氧化足量的KI,得到I2最少的
是 ( )
A.Fe3+ B.MnO4- C.Cl2 D.HNO3
15.在高科技工业,有的高分子材料能用在各种能量的转换上,如传感膜能够把化学能转化
为电能,热电膜能够把热能转化成电能等,这种高分子材料是 ( )
A.高分子分离膜 B.医用高分子材料 C.生物高分子材料 D.液晶高分子材料
16.元素周期表中第七周期为不完全周期,若将来的发现把第七周期全排满,则下列推论可
能错误的是
A.第七周期元素都是放射性元素 ( )
B.该周期原子序数最大的元素单质一定不与任何物质反应
C.该周期0族元素的原子序数为118
D.该周期ⅢA族元素的氢氧化物性质与Al(OH)3不同
17.已知在某温度下,将1 mol SO3(g)充入一定容积的密闭容器中,反应:
2SO3![]() 2SO2(g)+O2(g)达到平衡时,混合气体的压强比起始时增大了20%。若起始
2SO2(g)+O2(g)达到平衡时,混合气体的压强比起始时增大了20%。若起始
充入1 mol SO2和1 mol O2,在相同条件下建立平衡,则该情况下SO2转化率为( )
A.20% B.20%~60% C.60% D.大于60%
18.烯烃、一氧化碳、氢气在催化剂的作用下生成醛的反应称为羰基合成,也叫烯烃的醛化
![]() 反应。由乙烯到丙醛的反应为:CH2==CH2+CO+H2 CH3CH2CHO。由分子式为C4H8
反应。由乙烯到丙醛的反应为:CH2==CH2+CO+H2 CH3CH2CHO。由分子式为C4H8
的烯烃进行醛化反应得到的醛的同分异构体可能有 ( )
A.2种 B.3种 C.4种 D.5种
第 Ⅱ 卷(非选择题 共78分)
三.(本题包括2小题,共19分)
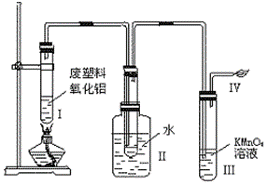
19.(10分)某研究性学习小组在研究塑料的降解时做了如下实验。
|
(1)写出你所知道的生成乙烯的化学方程
式。
(2)Ⅲ中的现象是 ,Ⅳ中的反应方程式是 。
据此现象提出你在治理白色污染方面的设想:
。
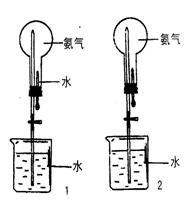
20.(10分)制取氨气并完成喷泉实验(图中夹持装置均已略去)
|
(2)收集氨气应使用___________法,
要制得干燥的氨气可选用___________做干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干
燥氨气引发水上喷的操作是_________________
_______________。该实验的原理是__________
________________________________________。
如果使喷泉的溶液最后呈红色应_____________。
(4)如图1装置进行喷泉实验,上部烧瓶中装满干燥的CO2,则应在图1装置上作何
改进_________________________________________________。
(5)如果只提供如图2的装置,请说明引发喷泉的方法________________________ _
。
四.(本题包括2小题,共20分)
21.(10分)将等物质的量的A、B、C、D四种物质混和,发生如下反应:
aA+bB![]() cC(固)+d D,当反应进行一定时间后,测得A减少了n mol,B减少了
cC(固)+d D,当反应进行一定时间后,测得A减少了n mol,B减少了
![]() mol,C增加了
mol,C增加了![]() n mol,D增加了n mol,此时达到化学平衡
n mol,D增加了n mol,此时达到化学平衡
(1)该化学方程式中各物质的系数为a=________,b=_______,c=_______,d=_______;
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状
态A___ ___,B___ _____,D_______ __。
(3)若只升高温度,反应一段时间后,测知四种物质的量又达到相等,则该反应为
__ _______反应(填放热或吸热)。
22.(10分)氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,产生比它的酸性更强
的酸,同时放出气体,该气体混合物经干燥后,平均分子量为47.6,它可以使带火星的
木条复燃,并可使润湿的淀粉碘化钾试纸变蓝后又褪色,试完成下列各题:
(1)该气体的组成是______________气体混合物的物质的量比为__________________
(2)写出氯酸分解方程式并配平该反应的还原产物是__________________。
(3)结合化学方程式解释,该气体使润湿的淀粉碘化钾试纸变蓝后又褪色的原因。
___ ______________________________________________________
___ ______________________________________________________
___ ______________________________________________________。
五.(本题包括2小题,共20分)
23.(10分)在某些酶的催化下,人体内葡萄糖的代谢有如下过程:
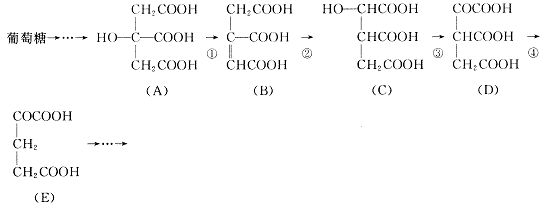
请填空:
(1)过程①是 反应,过程②是 反应,过程③是 反
应(填写反应类型的名称)。
(2)过程④的另一种生成物是 (填写化学式)。
(3)上述物质中 和 互为同分异构体(填写字母代号)
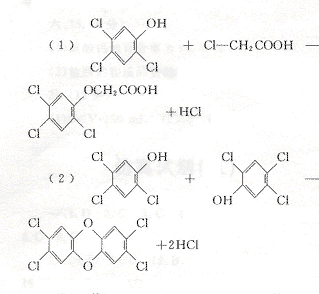
24.(10分)2,4,5—三氯苯酚和氯乙酸反应可制得除草剂2,4,5-三氯苯氧乙酸。某生
产该除草剂的工厂在一次事故中泄漏出一种二恶英,简称为
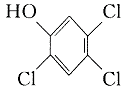 TCDD。有关物质的结构式如下:
TCDD。有关物质的结构式如下:
三氯苯酚 氯乙酸Cl—CH2COOH
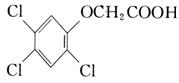
请写出:
|
反应的化学方程式:
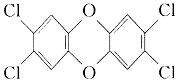
(2)(4分)2,4,5—三氯苯酚生成TCDD
反应的化学方程式 。
六.(本题包括2小题,共19分)
25.(7分)将Na2CO3和NaHCO3的混合物5.48g加热到质量不再减轻时,测得残留固体
4.24g。另取一定质量的此混合物固体,跟100mL某浓度的盐酸刚好完全反应,并收集
到 672mLCO2气体(标准状况下)求:
(1)此混合物中NaHCO3的质量百分含量;
(2)所用盐酸的物质的量浓度。
26.(12分)将10克铁粉置于40mL硝酸中,再微热,反应过程随着硝酸浓度的降低,生成
气体的颜色由红棕色逐渐变为无色,充分反应后,共收集到1.792L混合气体(标准状况),
此时溶液中还残留4.4克固体。
(1)求该反应中被还原的硝酸和未被还原的硝酸的质量比;
(2)求原硝酸溶液的物质的量浓度;
(3)求混合气体中NO和NO2的体积比。
新课程高三化学综合测试
参考答案
综合五
1.B 2.D 3.B 4.D 5.C 6.B 7.C 8.C 9.C 10.D 11.BD 12.D 13.A 14.A 15.A 16.B
![]() 17.D 18.C
17.D 18.C
![]() 19.(9分)
(1)CH≡CH+H2 CH2==CH2(2分) CH3CH2OH
CH2==CH2+H2O(2分)
19.(9分)
(1)CH≡CH+H2 CH2==CH2(2分) CH3CH2OH
CH2==CH2+H2O(2分)
![]() C4H10 CH2==CH2+CH3—CH3 (2分)
C4H10 CH2==CH2+CH3—CH3 (2分)
(2)高锰酸钾溶液褪色; CH2==CH2+3O2 2CO2+2H2O 选择更为理想的催化剂,使得塑料
的降解可以在工业生产方面大规模进行,这样既治理了白色污染,又生产了汽油,还提高了汽油的产量
(3分)
20.(共10分)每线2分
(1)Ca(OH)2+2NH4C1![]() CaCl2+2NH3↑+2H2O (2)向下排空气法 碱石灰
CaCl2+2NH3↑+2H2O (2)向下排空气法 碱石灰
(3)挤压胶头滴管使其中水进入烧瓶 氨气极易溶于水,使烧瓶内压强减小,形成喷泉在烧杯中滴加
酚酞试液 (4)滴管中烧杯中用NaOH溶液
(5)用双手捂住烧瓶,使烧瓶内气体受热排出少量,松开手形成喷泉。
21.(8分)每线1分 (1)2、l、3、2 (2)气态、固态或液态、气态 (3)放热
22.(10分)每线2分
(1)O2、Cl2 3:2(或C12 O2 2:3)
(2)8HClO3=4HClO4+3O2↑+2C12↑+2H2O C12
(也可以3、1、2、1、1 5、3、1、1、1 12、8、1、2、2等正确的都给分)
(3)2KI+Cl2=2KCl+I2(变蓝)I2+5Cl2+6H2O=2HIO3+10HCl(褪色)
23.(10分)(1)消去 加成 氧化 (2)CO2 (3)A C
24.(10分)
![]()
25.(7分)[提示说明]
解:(1)设混合物中含NaHCO3 x g
2NaHCO3 ![]() Na2CO3+CO2↑+H2O 质量减少
Na2CO3+CO2↑+H2O 质量减少
2×84 106 168-106=62
x 5.48-4.24=1.24
x =3.36g
∴NaHCO3%=![]() ×100%=61.3%
(3分)
×100%=61.3%
(3分)
⑵由⑴的计算结果可求出n(NaHCO3):n(Na2CO3)=![]() :
:![]() = 2∶1
= 2∶1
则由:
NaHCO3+HCl=NaCl+CO2↑+H2O
2x′ 2x′ 2x′
Na2CO3+2HCl=2NaCl+CO2↑+H2O
x′ 2x′ x′
依题意得2x′+ x′=![]() =0.03mol
=0.03mol
∴x′=0.01mol
故消耗HCl的总的物质的量为4×0.01=0.04 mol,盐酸的物质的量浓度为
![]() (4分)
(4分)
26.(12分) (1)2:5 (4分) (2)7mol/L (4分) (3)3:1 (4分)